最近の研究成果
新たな妊婦と新生児のCMVスクリーニング方法
2021年11月29日
手稲渓仁会病院 不育症センター 山田秀人
まとめ
サイトメガロウイルス(CMV)はTORCH症候群の中で胎児感染の頻度が1番多く、年間約1000人の乳幼児に神経学的後遺症をきたす。最近は、先天性感染児の症候性・無症候性の割合や後遺症リスクは、母体の妊娠中のCMV初感染・非初感染の別に関わらず同程度とされる。全妊婦を対象とした抗体(CMV IgG、IgM)スクリーニングでは、半数以上をしめるCMV非初感染(再活性化・再感染)による先天性感染児を見逃すことが分かった。CMV IgG avidity indexの検査はまだ標準化されておらず、保険収載と適用はない。妊婦ターゲットスクリーニングとして、リスク因子の症状や所見を認めた場合にはCMV抗体を測定し、IgG陽性であればIgMの結果に関わらず保険適用で新生児尿核酸検査を行う。先天性感染リスクがある妊婦の出生児や聴覚スクリーニングでリファー(要再検)の新生児には、先天性CMV感染疑いの保険病名で新生児尿CMV核酸検査を生後3週以内にその分娩施設で必ず行う。
CMV母子感染と先天性感染児の後遺症リスク
現在、有効性が証明されたCMVワクチンはない。全妊婦を対象とした血清学的検査によるCMV妊婦スクリーニングは、世界的にみてもガイドライン等で推奨している国はない。日本人では約3割を占めるCMVに免疫がない妊婦が1~2%の頻度で妊娠中にCMVの初感染を起こし、その30~40%が胎児感染に至り先天性CMV感染児が出生する。一方、約7割を占めるCMV抗体をもつ非初感染妊婦からは、CMVの再活性化ないし再感染によって、0.5~1%の頻度で先天性感染児が出生する。これまで、先天性CMV感染児は初感染妊婦から多く出生し、症候性の割合や後遺症リスクも非初感染妊婦から出生する先天性感染児より多いと考えられていた。
しかしながら、近年、先天性CMV感染児の75%は非初感染妊婦から出生し1)、先天性感染児の神経画像所見や難聴の後遺症は、妊娠中CMV初感染の妊婦と非初感染妊婦では同程度であることが報告された2-4)。フィンランドの登録コホート研究は、症候性感染児の54%は非初感染妊婦から出生することを明らかにした5)。我々は日本での前向きコホート研究として、CMV IgG、IgM、IgG avidity index(AI)を用いた妊婦抗体スクリーニングと新生児尿CMV-DNAスクリーニングを実施した。その結果、先天性感染児の70%はCMV非初感染妊婦から出生し、症候性感染児の75%は非初感染妊婦から出生することを明らかにした6)。
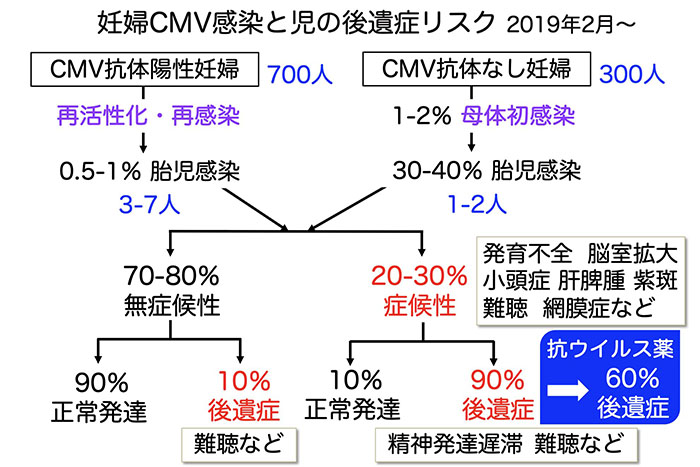
以上のことをふまえて、これまで信じられていたドグマとは異なる、より正確なCMV母子感染と先天性感染児の後遺症リスクを図に示す。日本では、妊婦1,000人中300人はCMV抗体が陰性で、700人が抗体陽性である。抗体陰性の300人から妊娠中のCMV初感染によって1~2人に胎児感染が起こる。一方、抗体陽性の非初感染の妊婦700人からCMV再活性化・再感染によって、3〜7人に胎児感染が起こる。全感染胎児の10%未満が最重症のため死亡となる。出生した先天性感染児では、症候性・無症候性の割合や後遺症リスクは、母体のCMV初感染・非初感染の別に関わらず同程度と考えられる。日本のコホート研究では、先天性感染児で症候性の割合は3割にのぼる7)。また、症候性児の抗ウイルス薬治療によって、後遺症リスクを6割に減少させる効果が期待される8)。
妊婦と新生児のCMVスクリーニング方法
観察研究では、超低出生体重の1.3%、SGAの1.7~3.7%、早産の3%に先天性CMV感染が起きた9-11)。我々の前向きコホート研究によって、胎児超音波異常、切迫流早産、早産、低出生体重、LFD、多胎、発熱・感冒症状、新生児の自動聴性脳幹反応(AABR)の要再検は、先天性CMV感染の発生のリスク因子であることを報告した6,12,13,14,15)。これらのリスク因子をもつ母児からの先天性CMV感染児の発生頻度は、全妊婦の抗体スクリーニングでCMV IgM陽性妊婦から発見される感染児の頻度(1.0%)6)より高いことが分かった。
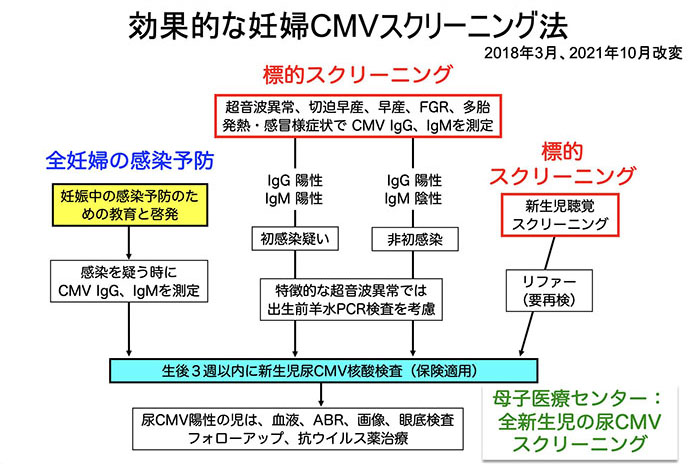
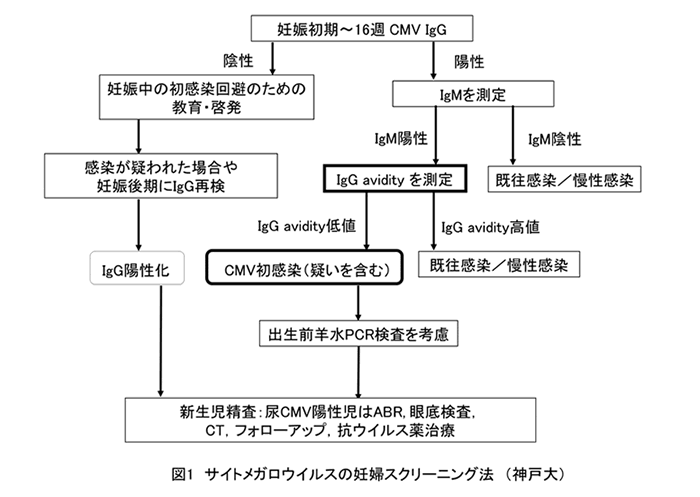
効果的な妊婦と新生児のCMVスクリーニング方法を提案する(図)。妊娠初期に全妊婦を対象として、妊娠中に初感染を起こさないように、表1にある感染予防の教育と啓発を行う。同時に、妊婦ターゲットスクリーニングとして、リスク因子の症状や所見を認めた場合には、CMV IgGとIgMを測定し、IgG陽性であれば、IgMの結果に関わらず保険適用で新生児尿核酸検査を行う。新生児ターゲットスクリーニングとして、新生児聴覚スクリーニングでリファー(要再検)は、必ず生後3週間以内に分娩施設で新生児尿核酸検査を実施する。ハイリスク妊娠を扱う周産期母子医療センターでは、およそ新生児200人に1人が先天性CMV感染で出生しているため、全新生児を対象とした尿スクリーニングの選択肢もある。新生児尿CMV核酸が陽性であれば先天性感染と診断し、画像や眼底検査等による精査を行い、フォローアップや抗ウイルス薬による新生児治療を行う。
母体のサイトメガロウイルス抗体検査
妊婦は、CMVに感染しても無症状か感冒症状を呈するのみである。血清学的に、初感染から1〜2週間で血清IgMが陽性となり、数ヶ月以上たって陰性化する。血清IgGは、2〜3週間で陽性化し生涯にわたって陽性が持続する。CMVの再感染や再活性化によって、母体血IgMが陽性となる場合もある。CMV IgMは偽陽性や、IgM陽性が1年以上続く persistent IgM の症例も存在する。したがって、母体血IgG陽性かつIgM陽性だけで、妊娠中の初感染と断定することはできない。IgM陽性妊婦のうち、本当の妊娠中の初感染者はその約3割とされる。AIによって、IgM陽性妊婦から本当の初感染妊婦を絞り込むことができる。妊娠中にCMV IgG陰性が陽性化した場合は、初感染と診断できる。CMV IgG, IgMは保険収載されている。
AI は、感染時期を推定するために用いられる。Avidityとは、IgGと抗原の結合力を表し、感染後の時間経過に伴いAIは上昇する。例えば、CMV AI高値 (>65%) は半年以上前の初感染が推定され、低値 (<30%) では2〜4ヶ月以内の初感染推定とされる。CMV IgM陽性の妊婦において胎児超音波異常ならびにAI低値が胎児感染の発生を予測する独立した因子であること16)、ならびにカットオフ値をAI<40%に設定した時に胎児感染を予測する正診率が最も高いこと17)が報告されている。
しかしながら、AI検査はまだ標準化されておらず、保険収載と保険適用はない。結局のところ、先天性CMV感染は非初感染妊婦からも起こるので、IgM陽性妊婦にAIの検査が必ず必要であるとは言えない。

出生前羊水検査
心配であれば羊水穿刺による羊水CMV DNA検査で先天性感染の有無がほぼ判定できる。ただし、妊娠22週未満やCMV感染後6週以内の羊水検査には、偽陰性が多いことが知られているので注意する。出生前診断の意義は以下である。
1) CMV DNA陰性で、現状より安心して妊娠を継続できる。
2) CMV DNA陽性で、高次施設へ紹介し、出生児の精査と診断や治療が受けられる。
新生児聴覚スクリーニングでリファー(要再検)となった場合
我が国では聴覚障害の早期発見のため、AABRによる新生児聴覚スクリーニング検査が推奨され、多くの施設で実施されている。この新生児聴覚スクリーニングで、リファー(要再検)になる新生児の中に、先天性CMV感染が5〜6%の頻度で存在する。したがって、日本耳鼻咽喉科学会および日本産婦人科医会が推奨しているように、新生児聴覚スクリーニング検査は、必ず生後入院中に産科施設で行う。リファー(要再検)となった場合は、出生した産科施設で生後3週までに新生児尿核酸検査を保険適用で行い、一方で耳鼻咽喉科に聴覚の精密検査を依頼する。尿核酸検査が陽性となった場合には小児科に紹介依頼し、先天性CMV感染児の精密検査を行う。先天性CMV感染を尿CMV核酸検査で診断するためには、必ず生後3週までに新生児聴覚スクリーニング検査を実施する。
新生児のウイルス検査
先天性CMV感染の診断は、生後3週間以内に新生児尿のCMV核酸検出法によって行う。生後3週間を超えると、先天性感染と後天性感染の区別が困難となる。血清中CMV IgMやCMV抗原血症は先天性CMV感染児であっても約半数で陰性となる10)。
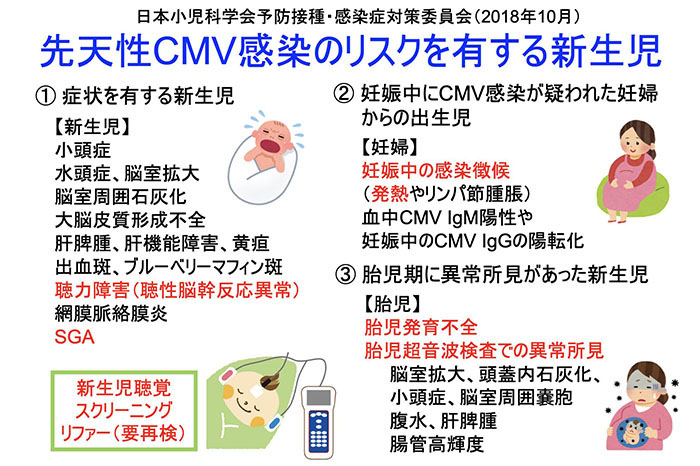
2018年1月より、新生児尿を用いたCMV核酸検査として、「サイトメガロウイルス核酸検出」が保険適用となった。先天性CMV感染の診断を目的として、等温核酸増幅法により測定した場合に1回に限り算定できる(保険点数850点)。感染症免疫学的検査のグロブリンクラス別CMV抗体検査をあわせて実施した場合には、主たるもののみを算定する。この尿核酸検査は、先天性CMV感染のリスク(表 2)を有する生後3週以内の新生児を対象に確定診断を目的とした定性試験である。現在、「ジェネリス CMV」(株式会社シノテスト)が、体外診断用医薬品として販売されている。SRL、LSIメディエンス、BMLで検査を受託している。
先天性CMV感染と確定診断された場合は、症候性・無症候性の鑑別のため、血算、生化学、CMV IgG、IgMに加えて、脳画像(頭部超音波,MRI)、AABRおよび眼底などの精査を行う。先天性感染児の約半数は、血清CMV IgMは陰性となる。先天性CMV感染に伴う難聴は、しばしば遅発性かつ進行性で幼児期発症もある。自閉スペクトラム症を含む様々な発達障害には、経過を追うことで早期診断や早期介入することができる。このため、小学校就学前までは発達や聴力の評価を定期的に行うことが必要である。
引用文献
1) Wang C, Zhang X, Bialek S, Cannon MJ. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection. Clin Infect Dis. 2011; 52(2): e11-e13.
2) Yamamoto AY, Mussi-Pinhata MM, Isaac Mde L, Amaral FR, Carvalheiro CG, Aragon DC, Manfredi AK, Boppana SB, Britt WJ. Congenital cytomegalovirus infection as a cause of sensorineural hearing loss in a highly immune population. Pediatr Infect Dis J. 2011; 30(12): 1043-1046.
3) Goderis J, De Leenheer E, Smets K, Van Hoecke H, Keymeulen A, Dhooge I. Hearing loss and congenital CMV infection: a systematic review. Pediatrics. 2014; 134(5): 972-982.
4) Giannattasio A, Di Costanzo P, De Matteis A, Milite P, De Martino D, Bucci L, Augurio MR, Bravaccio C, Ferrara T, Capasso L, Raimondi F. Outcomes of congenital cytomegalovirus disease following maternal primary and non-primary infection. J Clin Virol. 2017; 96: 32-36.
5) Puhakka L, Renko M, Helminen M, Peltola V, Heiskanen-Kosma T, Lappalainen M, Surcel HM, Lönnqvist T, Saxen H. Primary versus non-primary maternal cytomegalovirus infection as a cause of symptomatic congenital infection - register-based study from Finland. Infect Dis. 2017; 49(6): 445-453.
6) Tanimura K, Tairaku S, Morioka I, Ozaki K, Nagamata S, Morizane M, Deguchi M, Ebina Y, Minematsu T, Yamada H. Universal screening with use of immunoglobulin G avidity for congenital cytomegalovirus infection. Clin Infect Dis. 2017; 65: 1652-1658.
7) Koyano S, Inoue N, Oka A, Moriuchi H, Asano K, Ito Y, Yamada H, Yoshikawa T, Suzutani T; Japanese Congenital Cytomegalovirus Study Group. Screening for congenital cytomegalovirus infection using newborn urine samples collected on filter paper: feasibility and outcomes from a multicentre study. BMJ Open. 2011; 1: e000118.doi: 10.1136/bmjopen-2011-000118.
8) Nishida K, Morioka I, Nakamachi Y, Kobayashi Y, Imanishi T, Kawano S, Iwatani S, Koda T, Deguchi M, Tanimura K, Yamashita D, Nibu K, Funakoshi T, Ohashi M, Inoue N, Iijima K, Yamada H. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment. Brain Dev. 2016; 38: 209–216.
9) Vaudry W, Rosychuk RJ, Lee BE, Cheung PY, Pang X, Preiksaitis JK. Congenital cytomegalovirus infection in high-risk Canadian infants: Report of a pilot screening study. Can J Infect Dis Med Microbiol. 2010; 21(1): e12-19.
10) van der Weiden S, de Jong EP, Te Pas AB, Middeldorp JM, Vossen AC, Rijken M, Walther FJ, Lopriore E. Is routine TORCH screening and urine CMV culture warranted in small for gestational age neonates?. Early Hum Dev. 2011; 87(2): 103-107.
11) Lorenzoni F, Lunardi S, Liumbruno A, Ferri G, Madrigali V, Fiorentini E, Forli F, Berrettini S, Boldrini A, Ghirri P. Neonatal screening for congenital cytomegalovirus infection in preterm and small for gestational age infants. J Matern Fetal Neonatal Med. 2014; 27(15): 1589-1593.
12) Tanimura K, Tairaku S, Ebina Y, Morioka I, Nagamata S, Deguchi K, Morizane M, Deguchi M, Minematsu T, Yamada H. Prediction of Congenital Cytomegalovirus Infection in High-Risk Pregnant Women. Clin Infect Dis. 2017; 15: 159-165.
13) Yamada H, Tanimura K, Tairaku S, Morioka I, Deguchi M, Morizane M, Nagamata S, Ozaki K, Ebina Y, Minematsu T. Clinical factor associated with congenital cytomegalovirus infection in pregnant women with non-primary infection. J Infect Chemother. 2018; 24(9): 702-706.
14)Uchida A, Tanimura K, Morizane M, Fujioka K, Morioka I, Oohashi M, Minematsu T, Yamada H. Clinical factors associated with congenital cytomegalovirus infection: A cohort study of pregnant women and newborns. Clin Infect Dis. 2020; 71(11): 2833-2839. doi: 10.1093/cid/ciz1156.
15) Imafuku H, Yamada H, Uchida A, Deguchi M, Shirakawa T, Sasagawa Y, Shi Y, Fujioka K, Morioka I, Tanimura K. Clinical and ultrasound features associated with congenital cytomegalovirus infection as potential predictors for targeted newborn screening in high-risk pregnancies. Sci Rep. 10(1):19706, 2020. doi: 10.1038/s41598-020-76772-1.
16)Sonoyama A, Ebina Y, Morioka I et al. Low IgG avidity and ultrasound fetal abnormality predict congenital cytomegalovirus infection. J Med Virol. 2012; 84: 1928-1933.
17)Ebina Y, Minematsu T, Sonoyama A et al. The IgG avidity value for the prediction of congenital cytomegalovirus infection in a prospective cohort study. J Perinat Med. 2014; 42: 755-759.
サイトメガロウイルス母子感染とは
2018年10月23日
神戸大学大学院医学研究科 産科婦人科学分野 山田秀人
はじめに
サイトメガロウイルス(CMV)はベータヘルペスウイルス科に分類され、正式名称はヒトヘルペスウイルス5(HHV-5)である。感染細胞がフクロウの目(owl’s eye)のような核内封入体を形成するのが病理学的特徴である。主に幼児時に感染し、ほとんどが不顕性感染の形で生涯に渡り潜伏感染する。感染経路として、母乳、小児の唾液や尿のほか、輸血による感染もみられる。母体初感染では無症状が多く、時に感冒様症状を呈する。一般的に、肝機能障害、肺炎、単核症などの症状を呈するのは先天性感染児、未熟児、移植後、HIV感染や免疫不全などの患者である。先天性感染児以外は、難聴や網膜炎などの神経学的障害の発生リスクは少ない。CMV による母子感染はTORCH症候群の中で一番頻度が多く、日本では年間約1000人の出生児に難聴や精神発達遅滞などの後遺症を起こす(表1)。

サイトメガロウイルス母子感染と出生児の後遺症リスク
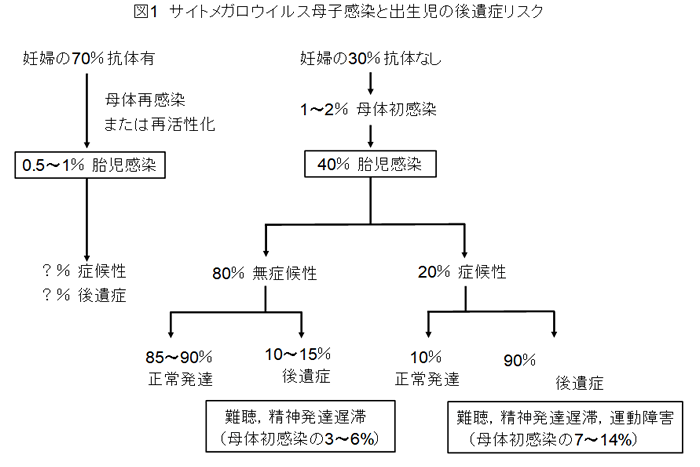
日本における妊婦のCMV抗体保有率は、約70%とされる。図1に示すように、CMV IgG陰性の妊婦の1~2%が妊娠中にCMV初感染を起こし、その約40%が胎児感染にいたる。胎児感染の20%が症候性で、80%は無症候性の先天性CMV感染児として出生する。主な症状は、胎児発育不全、肝脾腫、小頭症、頭蓋内石灰化、脳室拡大、腹水などである。症候性の先天性感染児の90%に、無症候性児の10~15%に精神発達遅滞、運動障害、難聴などの後遺症が残る。妊娠前からCMV IgG陽性の非初感染妊婦では、ウイルスの再感染や再活性化によって、0.5~1.0%が先天性感染児を出生する。これまで初感染妊婦からの感染児の方が、症候性や後遺症が多いと考えられてきた。しかし、感染児数、重症度と後遺症の頻度は初感染と非初感染妊婦とでは同等であるとの報告もある1-4)。
厚生労働科学研究(平成20~22年度古谷野班、平成23~24年度山田班)の新生児24000人のコホート研究によって、以下のことを明らかにした5),6)。1)先天性CMV感染の頻度は新生児300人に1人。2)症候性の先天性感染は新生児1000人に1人。3)感染児はSGAの割合が多い。4)無症候性児に比べ症候性児では血中ウイルス量が多い。5)主な感染ルートは年長児から妊婦への感染。6)先天性CMV感染をほとんどの妊婦が知らない。7)教育と啓発のためのホームページを作成した。8)症候性児で抗ウイルス薬の治療効果がある。
4段階のサイトメガロウイルス母子感染対策
CMV母子感染の対策方法として、次の4段階がある。1)妊婦抗体スクリーニングと教育・啓発。2)初感染妊婦における胎児感染の予防。3)症候性感染胎児の治療。4)新生児尿スクリーニングと介入(ABR検査、抗ウイルス薬治療)。
このうち、「初感染妊婦への免疫グロブリンの母体静脈内投与」については、イタリアの無作為二重盲検試験(CHIPS study)で感染予防効果は認められなかった7)。神戸大学でも臨床研究として、初感染妊婦5人に免疫グロブリンの投与を行ったが4人に先天性感染が起き、感染予防効果を認めていない8)。
ワクチン開発については、これまでのgB糖タンパクワクチンの母子感染予防効果は限定的で、実用化には至っていない。近年、5つのgHタンパクを同時にターゲットにしたペンタメトリックコンプレックス(PC)ワクチンの開発が進められている。
妊婦抗体スクリーニングと教育・啓発
全妊婦に対するCMV抗体スクリーニングの有用性は明らかではない。スクリーニング方法案の1つを図2に示す。妊娠初期にCMV IgGを測定し、陰性者にパンフレットを用いて妊娠中の初感染を予防するための教育と啓発を行う。多くの妊婦はCMVについて、また妊娠中の初感染が胎児に影響する認識が乏しい。症状、感染経路、児への影響を説明したうえで、CMVを含んでいる可能性のある小児の唾液や尿との接触をなるべく避けるよう、十分な手指衛生を心がけるように教育し啓発する(表2)。抗体陰性妊婦は、妊娠34、35週にCMV IgGを再測定する。抗体陽性化は初感染と判断し、新生児尿CMV検査を行う。
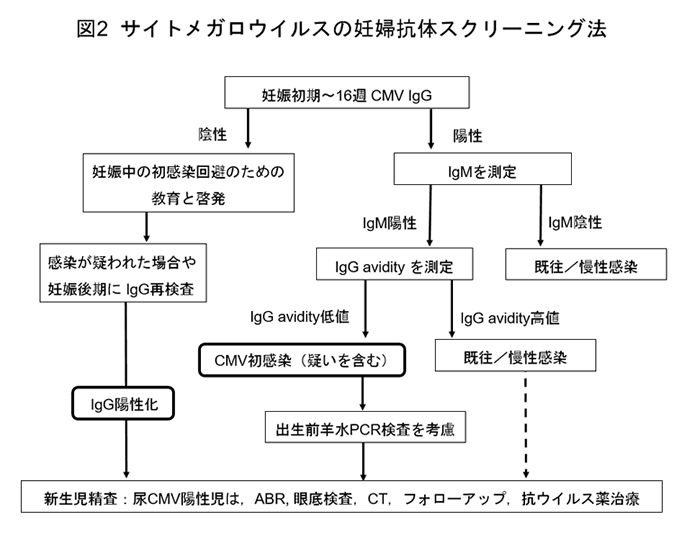

IgG陽性妊婦はIgMを測定し、IgM陽性では超音波検査やIgG avidity index(AI)を測定する。AI低値(≦35~45%)であれば妊娠中初感染の可能性がある9,10)ので出生児の精査を行う。しかしながら、妊婦抗体スクリーニングによって、実際に先天性感染児の何割が同定できるか、臨床上有用であるかは不明であった。
妊婦抗体スクリーニングは果たして有用か?
妊婦CMV抗体スクリーニングの有用性を、前方視的コホート研究によって明らかにすることを目的とした。2010年2月~2016年4月の間、CMV IgM 陽性の紹介例を除き、妊婦抗体スクリーニングを行い分娩となった母児2193組を対象とした(図3)。第一に、CMV IgG AI スクリーニングによる先天性感染の予知効率を調べた。次に、CMV IgG 陽性者の保存血清を用いてCMV IgM を測定し、AI と IgM のスクリーニング効率を比較した。図3にその結果を示す。631人がIgG陰性で、うち5人(0.8%)が妊娠後期にIgG が陽性化し初感染と診断され、無症候性の先天性感染児1人が出生した。1562人はIgGが陽性で、AI≦45%は183人、うち95人がAI≦35%ないしIgM陽性で妊娠中の初感染が疑われ、この初感染妊婦から無症候性1人と症候性1人の感染児が出生した。一方、1379人がAI>45%で、この非初感染妊婦から感染児が7人(症候性3人、無症候性4人)出生した。母体血清 IgMは、7人とも陰性であった。
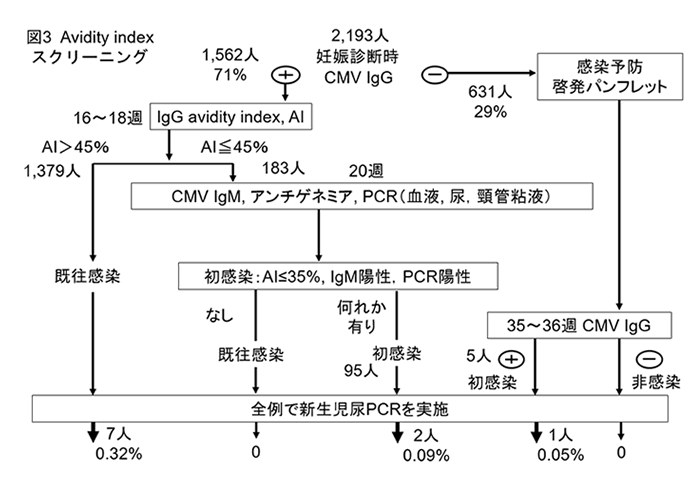
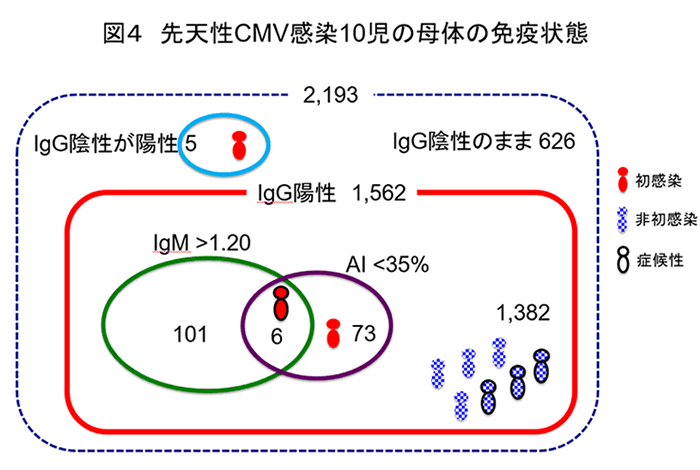
図4に、10人の先天性感染児を出産した母体のCMVに対する免疫状態を示す。AIないしIgMを用いた抗体スクリーニングによる先天性感染の予知効率はそれぞれ、感度(AI 22%/IgM 11%)、特異度(95/93%)、陽性的中率(2.5/0.9%)、陰性的中率(99/99%)、正診率(95/93%)であり、特に感度と陽性的中率が相当低いことが判明した。IgG(再検査を含む)とAIやIgMを用いた妊婦抗体スクリーニングでは、先天性感染児10人中3人しか予知することができない。7人の先天性感染児は非初感染妊婦から出生し、新生児尿スクリーニングによって初めて発見された。先天性感染児の半数以上が、妊婦抗体スクリーニングでは見逃されることが明らかとなった11)。
非初感染妊婦における先天性感染のリスク因子
コホート内症例対照研究の手法で、CMV非初感染(母体血AI>45%かつIgM<0.8)の妊婦1287人中、先天性感染有り7人となしの1280人に分け、先天性感染の発生に関連する臨床所見や妊娠合併症(感冒症状、高血圧、甲状腺疾患、免疫抑制剤、切迫早産、多胎、FGR、早産、LFD)を多変量ロジスティック回帰分析で調べた。結果、単変量解析で切迫早産と多胎が有意な因子であり、多変量解析では切迫早産(OR 8.4, 95%CI 1.5-48)が唯一、非初感染妊婦における先天性感染のリスク因子であることを初めて明らかにした。出血や細菌感染など子宮局所の炎症によって、マクロファージやDCに潜伏感染していたウイルスが活性化され、胎児感染を引き起こすと推察する。切迫早産の定義は、1週間以上の入院安静および硫酸マグネシウムや塩酸リトドリンの静脈内投与が必要な状態とした12)。
サイトメガロウイルスIgM陽性妊婦における先天性感染の予知因子
先天性感染の発生を予知する臨床検査所見について、2009年6月~2016年2月の間、紹介例を含んだCMV IgM陽性の妊婦300人を対象に前向きコホート研究を行った。感冒症状問診、AI、アンチゲネミア(C7-HRP)、母体血・尿・頸管粘液CMV-DNA PCR、超音波断層法の検査を行い、出生児は尿CMV-DNA PCR検査を行った。多変量ロジスティック回帰分析により、先天性感染の発生を出生前に予知する因子を決定した。
先天性感染児は、22人(7.3%)であった。単変量解析で感冒様症状、胎児超音波異常、CMV IgM高値、アンチゲネミア陽性、AI<40%、頸管PCR陽性が有意な因子であり、多変量解析では胎児超音波異常(OR 32, 95%CI 8.5-120)と頸管PCR陽性(OR 16, 95%CI 5.0-54)は、独立した先天性感染の予知因子であった。胎児超音波異常/頸管PCR陽性の先天性感染に対する感度、特異度、陽性的中率、陰性的中率、正診率はそれぞれ、50/50%、98/94%、61/41%、96/96%、94/91%であった13)。IgM陽性妊婦に胎児超音波異常があれば約6割に、頸管PCRが陽性であれば約4割に先天性感染が発生する。脳室拡大、小頭症、頭蓋内石灰化、胸腹水、肝脾腫は先天性感染に特異的な異常所見であった。頸管PCR陽性が予知因子であることは、世界で初めての知見である。感染した羊水から卵膜を通してウイルスが頸管に漏れ出ると推察する。
先天性サイトメガロウイルス感染が疑われる出生児の精査
新生児尿からCMVを検出することで先天性CMV感染の確定診断ができる。生後3週間を超えると、先天性感染と後天性感染の区別が困難となるため、先天性感染が疑われた場合には生後3週以内の尿を採取し検査を行う。血液より尿の方が検出感度は高い。補助診断および症候性と無症候性の鑑別のために、血算、生化学、CMV IgG/IgM、CMV抗原血症(CMV pp65抗原検出、C7-HRP法)、画像(頭部超音波、CT、MRI)、聴性脳幹反応(ABR)、眼底などの検査を行う。先天性感染児の約半数は血液CMV IgMが陰性となる14)。ABR異常はしばしば生後数ヶ月後に出現する。症候性の感染児では、(バル)ガンシクロビル治療を考慮する。2018年1月に、等温核酸増幅法(Smart Amp法)による新生児尿CMV核酸検査(ジェネリスCMV)が、850点で保険収載された。感染が疑われる新生児に対して、保険適用で尿CMV検査が可能となった。
新生児尿スクリーニングと抗ウイルス薬治療
Kimberlin らは、ランダム化二重盲検試験で抗ウイルス薬治療により症候性感染児の聴力が改善することを2003年に報告した15)。GCV投与群で聴力は17%改善したが、非投与群では改善例はなく7割が悪化した。そして、VGCV 6ヵ月投与は6週投与に比べて難聴と発達の改善効果が高いことを2015年に発表した16)。
2009年から神戸大学関連3施設において、ろ紙を用いた新生児尿CMVスクリーニングのコホート研究を行なった(図5)。2017年までに新生児11322人から、先天性感染児55人(0.49%)がみつかり、無症候性は32人で、うち1人が遅発性の片側難聴の後遺症がある。遅れて発症した難聴で、通常のABRスクリーニングでは見逃されるケースである。一方、23人が症候性で20人に治療を行い、15人の神経学的評価を行った。先天性感染の発生頻度は、大学病院0.69%、県内の総合周産期母子医療センターで0.52%、産科クリニックは0.24%であった。通常のクリニックで400人に1人、周産期センターでは200人に1人の割合で感染児が出生していた。この発生頻度の差は、超音波異常、切迫早産、多胎など先天性感染リスクと関連する産科異常の症例が、周産期センターに紹介や搬送されているためと考える。
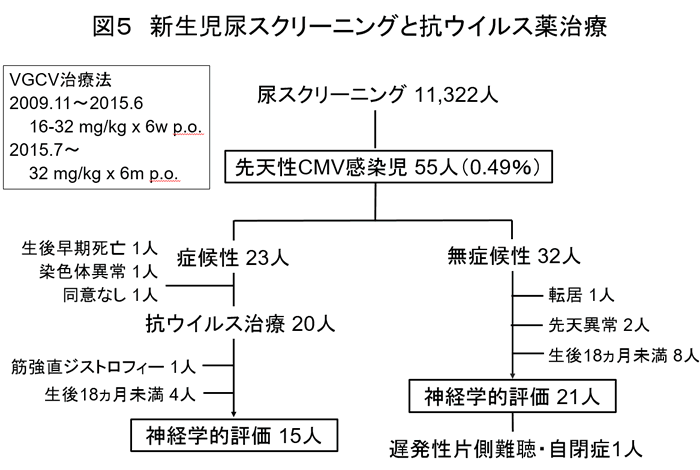
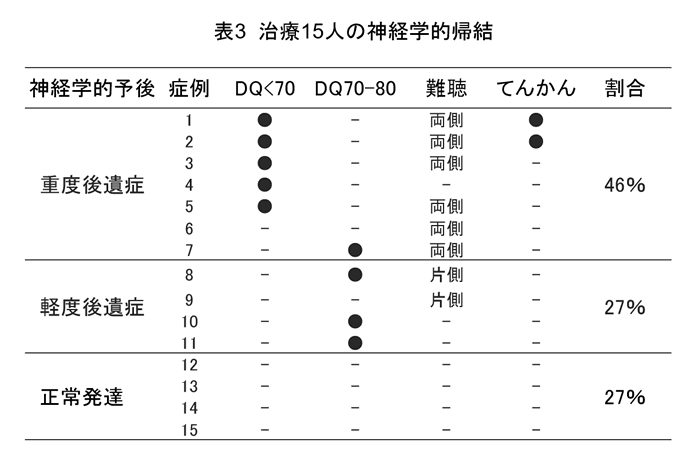
表3に抗ウイルス薬治療を行った症候性感染児15人の神経学的帰結を示す。症候性の先天性CMV感染児の70~90%が重度の後遺症をきたすとされるが、重度後遺症は減少し軽度後遺症と正常発達がそれぞれ27%を占めることから、抗ウイルス薬治療によって神経学的予後が改善したと考えられる。尿スクリーニング、正確な診断および適切な治療を行うことによって、感染児の後遺症が減少する可能性がある。ただし、小頭症、血小板減少、肝機能障害の症例では治療効果は限定的であった。
米国では1年間に40000人の感染児が出生、うち8000人が後遺症を残し、先天性CMV感染児にかかる医療費は年19~24 億ドルと報告されている。これにならうと、日本では年4000人の感染児が出生、うち1000人が後遺症を残し、かかる医療費は年260~330億円と推計できる。もし、尿スクリーニングと検査、診断、新生児治療によって、出生児の後遺症が30%抑制できるとすれば、少なくとも80億円の医療費が削減されることになる。尿CMV検査の費用は米国では10~50ドルとされる。日本で全新生児に尿スクリーニングを実施すると、検査と治療費用を含めても80億円でまかなうことができ、かつ感染児の後遺症が減少するであろう。新生児尿CMVユニバーサルスクリーニングの後遺症改善に対する費用対効果について、さらに検討が必要である。
免疫グロブリン胎児治療
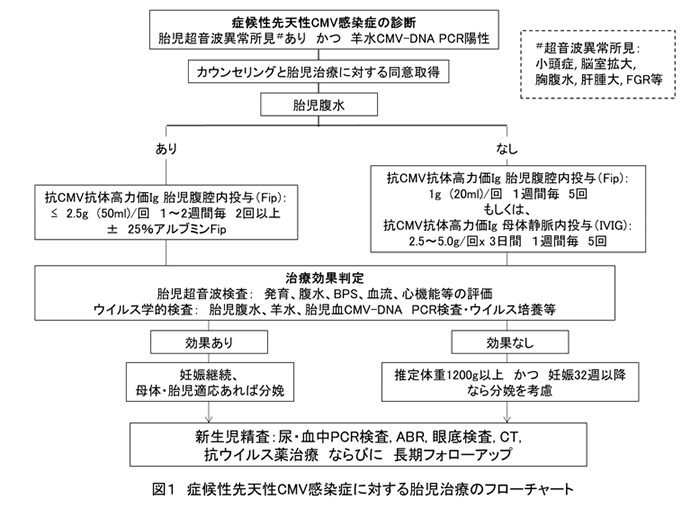
我々は1995年に世界で初めて、腹水のある先天性CMV感染胎児に免疫グロブリン胎児治療を行った17)。胎児腹水を除去した後、高力価免疫グロブリンを2.5gずつ妊娠28週と29週に腹腔内に投与を行なった。妊娠34週に帝王切開で出生し、頭蓋内石灰化があったが後遺症はない。その後、日本で2005年から症候性先天性感染に対する免疫グロブリン胎児治療(腹腔内、母体静脈内投与)の多施設共同研究を開始した。2010年4月までに多施設で合計12人に実施し、生存率83%、正常発達30%で、片側難聴のみは20%の結果で、胎児治療は有用である可能性を示した18)。
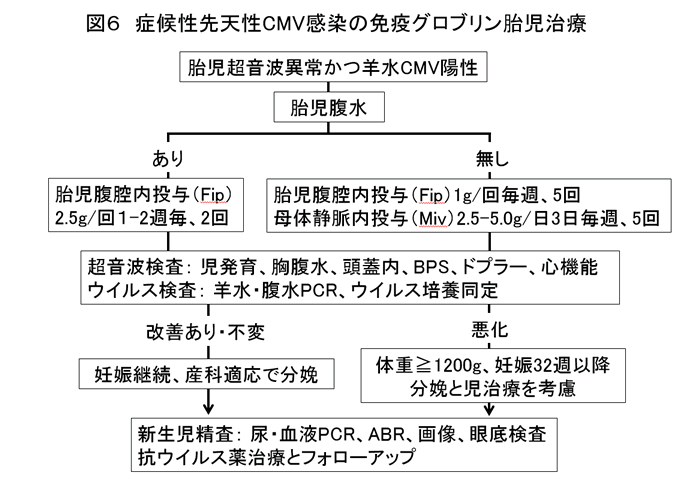
2009年以降、神戸大学では症候性先天性感染への免疫グロブリン胎児治療を継続している(図6)。超音波異常があり、かつ羊水CMV陽性で腹水がある場合、2.5gの免疫グロブリンの胎児腹腔内投与を行う。腹水がない場合、1gを胎児腹腔内ないし2.5~5.0gを母体静脈内に投与する。症候の改善があれば正期まで妊娠を継続し、悪化する場合には人工早産と新生児の抗ウイルス薬治療を考慮する。
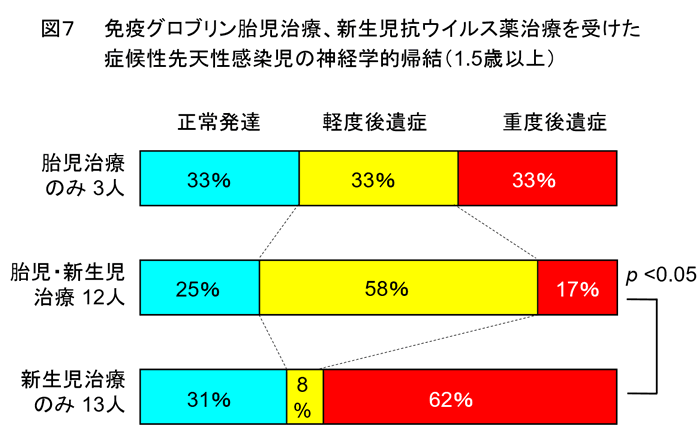
2005年から2016年6月までに、多施設研究としてまたは神戸大学で、免疫グロブリン胎児治療ないし新生児抗ウイルス薬治療を受けた、症候性先天性感染28人(生存1.5歳以上)の神経学的帰結を比較した(図7)。その結果、胎児治療と新生児治療の両方を受けた12人は、新生児治療のみの13人に比べて、有意に重症後遺症が少なかった。免疫グロブリン胎児治療と新生児抗ウイルス薬治療を組み合わせることで、症候性感染児の後遺症を抑制できる可能性がある。
まとめと提言
4段階の母子感染の対策方法のうち、妊婦抗体スクリーニングは半数以上の先天性感染児を見逃すことがわかった。初感染妊婦への免疫グロブリン投与による胎児感染予防の臨床研究は、世界的に有効性を認めていない。免疫グロブリン胎児治療は、病変が軽微な症例に後遺症抑制の効果があるであろう。一方、新生児尿スクリーニング、ABR検査や抗ウイルス薬治療は有用である可能性が高い。
現状からの提言として、以下に記す。1)パンフレットなどを用いて、妊婦のCMV感染予防の教育と啓発を必ず行う。2)妊婦CMV抗体スクリーニングは、妊娠初期にCMV IgG検査のみを自費で行なう。理由は、IgM検査をしても、IgM 陽性妊婦の1%~2%からしか感染児が出生しない。これは全先天性感染児の1~2割でしかないので効率が悪い。IgM陽性妊婦の98~99%に不安だけをもたらす。3)超音波異常、切迫早産、FGR、感冒症状を認める妊婦では、CMV抗体を測定する。IgGないしIgM 陽性妊婦の出生児は、尿CMV検査を保険適用で行う。4)施設の判断で新生児尿CMVスクリーニングを自費で行う。特に周産期センターでは、先天性CMV感染の頻度は出生児200人に1人である。
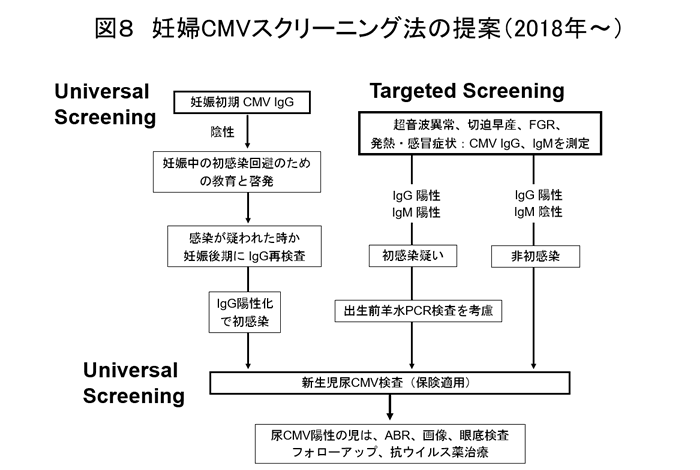
2018年以降、新生児尿CMV核酸検査が保険適用となったため、新たな妊婦CMVスクリーニング法を提案する(図8)。すべて同意を得て行う。全妊婦にCMV IgGのユニバーサルスクリーニングを行う。IgG陰性妊婦に感染予防の教育と啓発を行い、妊娠34、35週に再度CMV IgGを測定する。一方で、ターゲットスクリーニングとして、超音波異常、切迫早産、FGR、発熱・感冒症状を認める妊婦では、CMV IgGとIgMを測定する。IgG陽性であれば、IgMの陽性陰性にかかわらず、尿CMV検査を保険適用で行なう。全新生児に尿CMVのユニバーサルススクリーニングを行う選択肢もある。ただし、新生児の抗ウイルス薬治療はまだ保険適用になっていないことに留意する。我々は、全新生児尿スクリーニングの有用性を明らかにすることを目標として、臨床研究を継続する。
引用文献
[1] Boppana SB, Fowler KB, Britt WJ, Stagno S, Pass RF. Symptomatic congenital cytomegalovirus infection in infants born to mothers with preexistingimmunity to cytomegalovirus. Pediatrics 1999; 104: 55-60.
[2] Ross SA, Fowler KB, Ashrith G, Stagno S, Britt WJ, Pass RF, Boppana SB. Hearing loss in children with congenital cytomegalovirus infection born tomothers with preexisting immunity. J Pediatr 2006; 148: 332-336.
[3] Wang C, Zhang X, Bialek S, Cannon MJ. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection. Clin Infect Dis 2011; 52: e11-13.
[4] Puhakka L, Renko M, Helminen M, Peltola V, Heiskanen-Kosma T, Lappalainen M, Surcel HM, Lonnqvist T, Saxen H.Primary versus non-primary maternal cytomegalovirus infection as a cause of symptomatic congenital infection - register-based study from Finland. Infect Dis (Lond) 2017; 49: 445-453.
[5] 古谷野伸(代表研究者).全新生児を対象とした先天性サイトメガロウイルス(CMV)感染スクリーニング体制の構築に向けたパイロット調査と感染児臨床像の解析エビデンスに基づく治療指針の基盤策定. 厚生労働科学研究費補助金(成育疾患克服等次世代育成基盤研究事業)平成20~22年度総合研究報告書. 2011; 1-188 (http://mhlw-grants.niph.go.jp/niph/search/NIST00.doよりダウンロード可能)
[6] 山田秀人(研究代表者).先天性サイトメガロウイルス感染症対策のための妊婦教育の効果の検討,妊婦・新生児スクリーニング体制の構築及び感染新生児の発症リスク同定に関する研究. 厚生労働科学研究費補助金(成育疾患克服等次世代育成基盤研究事業)平成23~24年度総合研究報告書. 2013; 1-201 (http://mhlw-grants.niph.go.jp/niph/search/NIST00.doよりダウンロード可能)
[7] Revello MG, Lazzarotto T, Guerra B, Spinillo A, Ferrazzi E, Kustermann A, Guaschino S, Vergani P, Todros T, Frusca T, Arossa A, Furione M, Rognoni V, Rizzo N, Gabrielli L, Klersy C, Gerna G; CHIP Study Group. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med 2014; 370: 1316-1326.
[8] Tanimura K, Tairaku S, Deguchi M, Sonoyama A, Morizane M, Ebina Y, Morioka I, Yamada H. Prophylactic intravenous immunoglobulin injections to mothers with primary cytomegalovirus infection. Kobe J Med Sci 2014; 60: E25-29.
[9] Sonoyama A, Ebina Y, Morioka I, Tanimura K, Morizane M, Tairaku S, Minematsu T, Inoue N, Yamada H. Low IgG avidity and ultrasound fetal abnormality predict congenital cytomegalovirus infection. J Med Virol 2012; 84: 1928-1933.
[10] Ebina Y, Minematsu T, Sonoyama A, Morioka I, Inoue N, Tairaku S, Nagamata S, Tanimura K, Morizane M, Deguchi M, Yamada H. The IgG avidity value for the prediction of congenital cytomegalovirus infection in a prospective cohort study. J Perinat Med 2014; 42: 755-759.
[11] Tanimura K, Tairaku S, Morioka I, Ozaki K, Nagamata S, Morizane M, Deguchi M, Ebina Y, Minematsu T, Yamada H. Universal Screening With Use of Immunoglobulin G Avidity for Congenital Cytomegalovirus Infection. Clin Infect Dis 2017; 65: 1652-1658. [12] Yamada H, Tanimura K, Tairaku S, Morioka I, Deguchi M, Morizane M, Nagamata S, Ozaki K, Ebina Y, Minematsu T. Clinical factor associated with congenital cytomegalovirus infection in pregnant women with non-primary infection. J Infect Chemother 2018; doi: 10.1016/j.jiac.2018.04.010.
[13] Tanimura K, Tairaku S, Ebina Y, Morioka I, Nagamata S, Deguchi K, Morizane M, Deguchi M, Minematsu T, Yamada H. Prediction of Congenital Cytomegalovirus Infection in High-Risk Pregnant Women. Clin Infect Dis 2017; 64: 159-165.
[14] Kobayashi Y, Morioka I, Koda T, Nakamachi Y, Okazaki Y, Noguchi Y, Ogi M, Chikahira M, Tanimura K, Ebina Y, Funakoshi T, Ohashi M, Iijima K, Inoue N, Kawano S, Yamada H. Low total IgM values and high cytomegalovirus loads in the blood of newborns with symptomatic congenital cytomegalovirus infection. J Perinat Med 2015; 43: 239-243.
[15] Kimberlin DW1, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M, Jacobs RF, Vaudry W, Pass RF, Kiell JM, Soong SJ, Whitley RJ; National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group.Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: a randomized, controlled trial. J Pediatr 2003; 143:16-25.
[16] Kimberlin DW, Jester PM, Sanchez PJ, Ahmed A, Arav-Boger R, Michaels MG, Ashouri N, Englund JA, Estrada B, Jacobs RF, Romero JR, Sood SK, Whitworth MS, Abzug MJ, Caserta MT, Fowler S, Lujan-Zilbermann J, Storch GA, DeBiasi RL, Han JY, Palmer A, Weiner LB, Bocchini JA, Dennehy PH, Finn A, Griffiths PD, Luck S, Gutierrez K, Halasa N, Homans J, Shane AL, Sharland M, Simonsen K, Vanchiere JA, Woods CR, Sabo DL, Aban I, Kuo H, James SH, Prichard MN, Griffin J, Giles D, Acosta EP, Whitley RJ; National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Valganciclovir for symptomatic congenital cytomegalovirus disease. N Engl J Med 2015; 372: 933-943.
[17] Negishi H, Yamada H, Hirayama E, Okuyama K, Sagawa T, Matsumoto Y, Fujimoto S. Intraperitoneal administration of cytomegalovirus hyperimmunoglobulin to the cytomegalovirus-infected fetus. J Perinatol 1998; 18: 466-469.
[18] Japanese Congenital Cytomegalovirus Infection Immunoglobulin Fetal Therapy Study Group. A trial of immunoglobulin fetal therapy for symptomatic congenital cytomegalovirus infection. J Reprod Immunol 2012; 95:73-79.
先天性感染を出生前に予測する方法
2017年3月18日
神戸大学大学院医学研究科 産科婦人科学分野 谷村憲司
現在のところ、有効なワクチンや胎児治療法が存在しないために、全妊婦を対象とした血清学的検査などによるCMV妊婦スクリーニングは世界的にみても推奨されていない。一方で、近年、症候性の先天性CMV感染児に抗ウイルス薬治療を生後早期から行うことによって、難聴だけでなく神経学的予後も改善する可能性が報告されるようになってきた。しかし、全新生児を対象とした先天性CMV感染のスクリーニングも実現しておらず、現状では、分娩前に先天性感染のハイリスク児をより正確に同定し、それらの児に対して先天性CMV感染のサーベイランスならびに新生児治療を行うことが効率的かつ現実的と考えられる。
我々は、神戸大学を受診する全妊婦を対象に、CMV-IgG, IgM, IgG avidity index(AI)を含む(図1)に示すアルゴリズムを用いた妊婦CMVスクリーニングを実施している。我々が、これまでに得た先天性CMV感染発生予測に関する4つの前向き研究の成果を紹介する。
① CMV-IgM陽性ならびに疑陽性妊婦における先天性感染の発生予測因子 [1]
2009年~2011年に神戸大学を受診し、CMV-IgG陽性かつCMV-IgMボーダーライン~陽性であった妊婦50人を対象とした。対象症例に対して、前向きにAI測定、母体血・尿・頸管粘液中CMV-DNA PCR検査、母体血CBC, CRP, 肝機能の測定、アンチゲネミア検査、問診による感冒様症状の有無、ならび、胎児超音波検査を実施した。先天性感染は、新生児尿CMV-DNA PCR検査によって確認し、症候性感染か否かに関しては、理学所見、眼底検査、頭部画像検査、聴性脳幹反応によって診断した。50人中9人に先天性感染を認め、9人中7人が症候性であった。多変量ロジスティック回帰分析の結果、AI(オッズ比(OR): 0.91, 95%信頼区間(CI): 0.83-0.99)と先天性CMV感染に関連した胎児超音波異常所見(OR:291.22, 95%CI: 2.72-31125.05)が独立した先天性感染発生を予測する因子として選択された。
② 先天性CMV感染発生を予測するIgG avidity indexのcutoff値 [2]
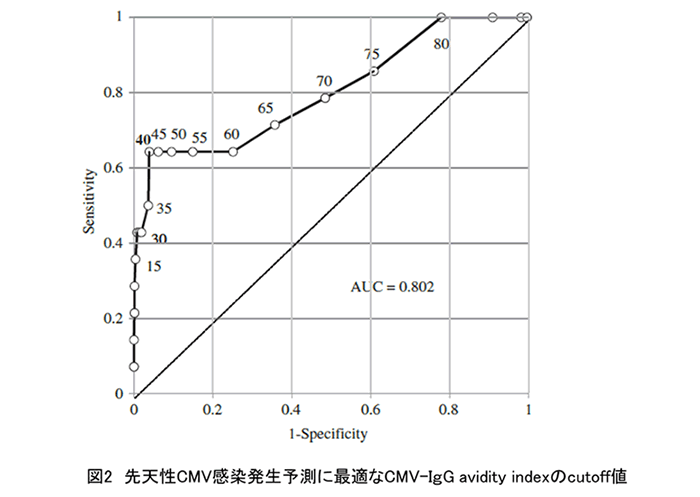
2009年~2013年に神戸大学を受診した妊婦に対して、妊娠16週~18週もしくは初診時にCMV-IgG検査を行い、IgG陽性の場合に、AI測定を行った。CMV-IgG陽性は759人、うち14人に先天性感染を認めた。ROC解析を用いて、先天性感染発生を予測するのに最適なAIのcutoff値を調べたところ、AI <40%が最適なcutoff値(感度96.1%、特異度64.3%)であることが分かった(図2)。さらに、AIの測定時期について検討すると、28週未満でAI <40%の先天性感染予測における精度は感度88.9%, 特異度96.2%, 陽性的中率27.6%, 陰性的中率99.8%で最良となることが分かった。
③ IgG avidity indexの経時的増加(ΔAI)と先天性感染発生の関連性 [3]
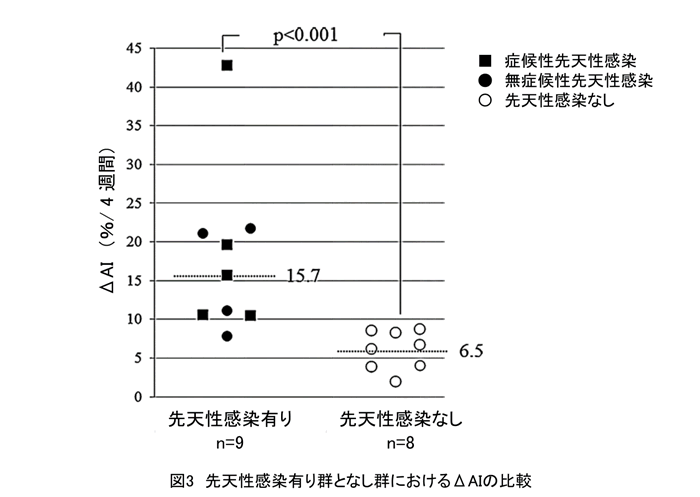
2010年~2013年に神戸大学を受診し、CMV-IgM疑陽性~陽性であった妊婦232人のうち、AI <40%かつ同意を得てAIを分娩までに再検した17人を対象とした。4週間でのAIの増加をΔAIとし、([2回目測定時AI(%)]-[1回目測定時AI(%)])×28/ (1回目測定~2回目測定までの間隔(日))として算出した。先天性感染を認めた9人のΔAI(中央値:15.7%, 範囲:7.8-42.8%)は、先天性感染を認めなかった8人のΔAI(中央値:6.5%, 範囲:2.0-8.8%)と比して有意に大きい(p<0.001)ことが分かった(図3)。特に、ΔAI>10%では、陽性的中率が100%(8人/8人)となった。以上より、AIの経時的増加(ΔAI)が大きい程、先天性感染発生リスクが高まる可能性を示した。
④ 先天性CMV感染ハイリスク妊婦における先天性感染の発生予測因子 [4]
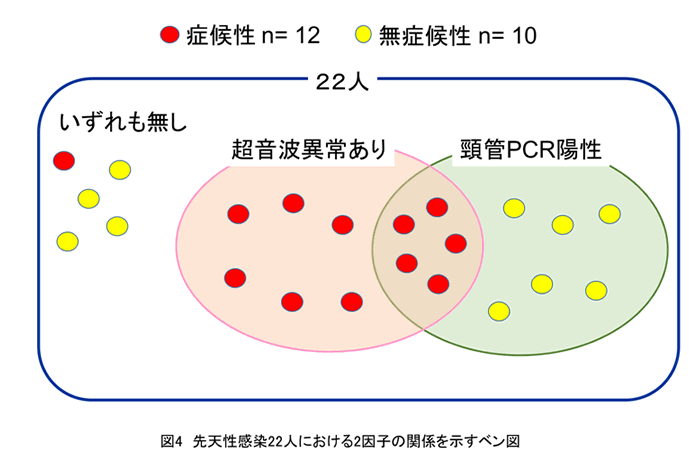
2009年~2016年に神戸大学を受診し、CMV-IgM陽性で妊娠中の初感染が疑われる先天性感染のハイリスク妊婦300人を対象として、感冒様症状の有無に関する問診や妊婦の血液検査、胎児超音波検査、妊婦の血液・尿・子宮頸管粘液中CMV-DNA PCR検査を全例に実施した。300人中22人に先天性感染を認めた。先天性感染の発生予測因子として、感冒様症状の有無、母体血中の白血球数、CRP、肝機能、CMV-IgG値、IgM値、アンチゲネミア陽性、AI低値(<40%)、先天性CMV感染を疑わせる胎児超音波異常所見を検討項目とした。多変量ロジスティック回帰分析の結果、胎児超音波異常所見(OR: 31.9, 95%CI: 8.5-120.3)と母体の子宮頸管粘液中CMV-DNA PCR陽性(OR: 16.4, 95%CI: 5.0-54.1)の2項目が先天性感染の出生前予測に最も有用であることが分かった(図4)。母親の子宮頸管粘液中のウイルスDNA検査を先天性感染の出生前予測に用い、しかも、有用であったとする報告は世界初である。この知見は、先天性CMV感染ハイリスク妊婦において、非侵襲的に先天性感染を予測する検査法の可能性を示すものと考えられる。
 参考文献
参考文献[1] Sonoyama A, Ebina Y, Morioka I, Tanimura K, Morizane M, Minematsu T, Inoue N, Yamada H. Low IgG avidity and ultrasound fetal abnormality were predictive of congenital cytomegalovirus infection. J Med Virol 84, 1928-1933, 2012
[2] Ebina Y, Minematsu T, Sonoyama A, Morioka I, Inoue N, Tairaku S, Nagamata S, Tanimura K, Morizane M, Deguchi M, Yamada H. The IgG avidity value for the prediction of congenital cytomegalovirus infection in a prospective cohort study. J Perinat Med 42(6),755-59, 2014
[3] Ebina Y, Minematsu T, Morioka I, Deguchi M, Tairaku S, Tanimura K, Sonoyama A, Nagamata S, Morizane M, Yamada H. Rapid increase in the serum cytomegalovirus IgG avidity index in women with a congenitally infected fetus. J Clin Virol 66, 44-47, 2015
[4] Tanimura K, Tairaku S, Ebina Y, Morioka I, Nagamata S, Deguchi K, Morizane M, Deguchi M, Minematsu T, Yamada H. Prediction of congenital cytomegalovirus infection in high-risk pregnant women. Clin Infect Dis doi: 10.1093/cid/ciw707, 2016
胎児治療と胎児感染予防法
2017年3月27日
神戸大学大学院医学研究科 産科婦人科学分野 谷村憲司
症候性先天性CMV感染児は、早期新生児死亡したり、生存したとしても90%が精神遅滞、運動障害、難聴などの後障害を残し、その予後は非常に厳しいことが分かっている。そこで出生前にすでに症候性であることが診断されている胎児に対する胎児治療が世界的に試みられているが、確立された方法はない。そんな中、我々は、2012年に抗CMV抗体高力価免疫グロブリン(Ig)製剤を用いた胎児治療の有用性に関する多施設共同研究の成果を報告した[1]。
これまで、他の研究グループが行ってきたIg製剤の投与法は母体の静脈内投与(IVIG)が主なものであったが、我々は、胎児により高濃度のIg投与が期待できる胎児腹腔内投与(Fip)を主に用いた(図1)。神戸大学と共同施設において、画像検査により、先天性CMV感染症に関連した胎児異常所見を認め、かつ、羊水や胎児の血液、腹水のウイルス培養やPCR検査が陽性より症候性先天性CMV感染と診断され、かつ、文書による同意が得られた症例に対して胎児治療を実施した。なお、出生児には2年以上にわたり神経学的な経過観察を行った。論文発表時点では、2005年~2010年に胎児治療を実施した12例での報告であったが、それ以降、2017年3月までに神戸大学で新たに7例に対して胎児治療が実施されており、今回は、追加症例も含めた19例について報告する。
胎児治療19例の内訳は、8例がFip単独、7例がFipとIVIGの併用、4例がIVIG単独であった。胎児治療後の胎児所見の変化として、腹水消失50%(5/10)、腹水減少10%(1/10)、胎児発育不全の改善60%(9/15)、軽度脳室拡大の消失33%(3/9)、肝腫大の消失20%(2/10)が観察された。生存率は84%(16/19)で、発達遅滞37% (7/19)、正常発達32%(6/19)、片側難聴のみ16%(3/19)であった。正常発達ないし片側難聴のみは47%(9/19)にのぼり、先述のように症候性感染児の後障害発生率は90%とされていることを考慮すると、我々の胎児治療法によって症候性感染児の後障害の発生や重症化を抑制できる可能性が示された。さらに、治療による母児への有害事象は認められなかった。
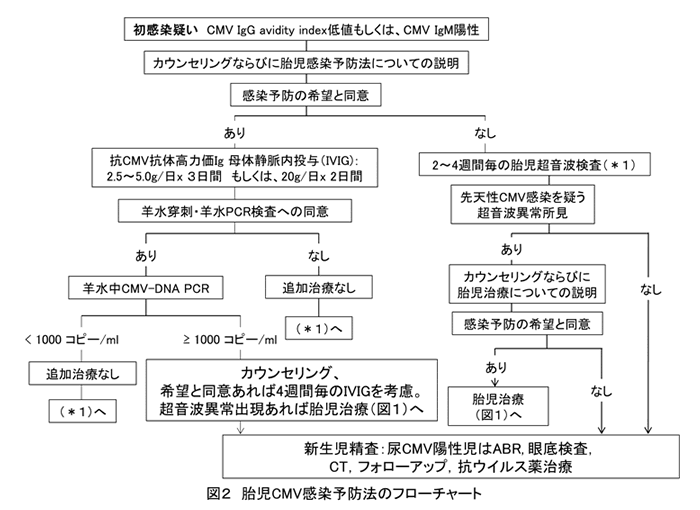
以上は、既に症状が出現してしまった胎児に対する治療について述べた。それとは別に、妊娠中にCMVに初感染してしまった妊婦に対して抗ウイルス薬やIg製剤を投与することで、胎児感染を予防しようとする試みがなされている。しかし、これに関してもエビデンスのある方法はない。そこで、我々は、神戸大学において、倫理委員会の承認を得て、CMV-IgG Avidity indexが35%以下と低値で、かつ、CMV-IgM陽性もしくは母体血CMV-DNA PCR検査が陽性より、初感染が強く疑われ、文書による同意が得られた妊婦に対してIVIGによる母子感染予防を実施している(図2)。これに関しても、論文発表時点では、2009年~2013年に胎児感染予防目的でIVIGを実施した4例での報告であったが[2]、それ以降、2017年3月までに1例の追加症例があり、計5例について報告する。治療を行う時点で最もCMV中和抗体価が高いロットのIg製剤を2.5~5.0g/日, 連続3日間、もしくは、20g/日, 連続2日間母体静脈内投与した。中絶2例、23週に前期破水して死産1例、2例が生児を得たが、中絶例のうち1例で胎児感染の確認が出来ておらず、その1例を除いた4例中3例(75%)で、新生児尿や臍帯血のCMV-DNA PCR陽性から胎児感染が確認され、現行のプロトコルでは胎児感染予防効果を期待することは難しいのではないかと考えられた。現在、初感染成立後のより早期により大量のIg製剤を投与することで効果が期待できないかを検討中である。
 参考文献
参考文献[1] Yamada H, Morizane M, Tanimura K, Morioka I, Ebina Y, Matsuda H, Yoshida M, Wakamatsu H, Furuya K, Murotsuki J, Saito S, Kawabata I, Takahashi Y, Ueda T, Sato Y, Kamitomo M, Maruyama Y, Hirano H, Yamada T, Minakami H, Yaegashi N, Minematsu T, Matsuoka R, Banzai M, Ikenoue T. A trial of immunoglobulin fetal therapy for symptomatic congenital cytomegalovirus infection. J Reprod Immunol 95(1-2), 73-79, 2012
[2] Tanimura K, Tairaku S, Deguchi M, Sonoyama A, Morizane M, Ebina Y, Morioka I, Yamada H. Prophylactic intravenous immunoglobulin injections to mothers with primary cytomegalovirus infection. Kobe J Med Sci 60(2), E25-E29, 2014
先天性感染症の診断と症候性感染児に対する治療効果
2017年3月18日
神戸大学大学院医学研究科 小児科学分野 森岡一朗
診断
先天性サイトメガロウイルス(CMV)感染症の確定診断は、生後3週以内の新生児の尿からPCR法によってCMV-DNAを検出することによって行う(ただし、現時点で保険適用はない)。実際の臨床現場では、保険適用のある血中CMV特異的IgM(CMV-IgM)やCMV抗原血症での診断が普及している。しかし、先天性CMV感染児における血中CMV-IgM、CMV抗原血症、血液CMV-DNAの診断検査としての意義は明らかではなかった。そこで、私たちは先天性CMV感染症と確定診断した新生児23人において、血中CMV-IgM、CMV抗原陽性細胞数(C7-HRP)、血液CMV-DNAを同時に測定し、その陽性の割合を算出した。各検査が陽性であった児の割合は、CMV-IgM 39%、C7-HRP 44%、血液CMV-DNA 96%であった [1]。血中CMV-IgMやCMV抗原血症だけを用いて診断した場合、多くの先天性感染児を見逃すことになることを明らかにした。
症候性先天性CMV感染症の主要症状の一つに脳室拡大がある。先天性感染児の脳室拡大の評価法は、小児放射線科医による定性評価が主流である。客観的な評価が可能な定量評価が望ましいと考えられるが、その方法は確立していなかった。私たちは、頭部CT画像でEvans’index (EI)及びlateral ventricle width/hemispheric width(LVW/HW)比を用いることで、先天性感染児の脳室拡大を定量評価ができることを示した [2]。
治療効果
従来、症候性先天性CMV感染症では出生時に症状がすでに固定されており、出生後の治療は効果がないとされてきた。しかし、2000年以降、海外から症候性先天性CMV感染症に対して抗CMV薬であるガンシクロビル(GCV)静脈内投与6週間治療により難聴や精神発達の改善効果があることが報告されてきた。長期にわたるGCVの静脈内投与は患者や家族、医療者への負担も大きいことから、最近では経口薬でGCVのプロドラッグであるバルガンシクロビル(VGCV)を用いても同様の効果が得られる可能性がある。
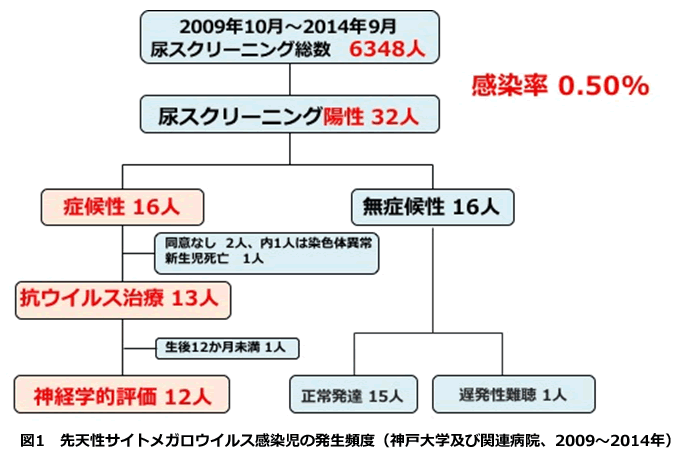
2009年10月から2014年9月までに、神戸市内の3施設(神戸大学病院、兵庫県立こども病院、なでしこレディースホスピタル)で出生した全新生児6348人に尿CMVスクリーニング検査を行い、32人(0.50%)の先天性CMV感染症児を同定した(図1)。同定された先天性CMV感染症児は神戸大学病院小児科で精査が行われ症候性と無症候性の診断を行った。症候性先天性CMV感染症と診断され16人のうち13人に6週間のVGCV治療が行った(図1)。そのうち12人の神経学的予後の評価を行われた(評価時月齢の中央値37か月)。結果、12人中5人(42%)で正常発達が得られた(表1)。少数例での検討ではあるが、無治療の場合には症候性先天性CMV感染症の90%程度に何らかの神経学的後遺症を残すとされてきたことを考慮するとVGCV治療により神経学的予後の改善が期待できる可能性がある [3]。
抗ウイルス治療は、バルガンシクロビルを16-32 mg/kg/日を6週間施行した。

一方、この抗ウイルス薬治療に関する課題も山積している。現在、我が国のみならず欧米諸国においても、GCVおよびVGCVは先天性CMV感染症に対する保険適用がない。短期的副作用の骨髄抑制、特に好中球減少は高率に発生する(自験例では12人中7人、58% [3])。その際は抗ウイルス薬治療の中断や顆粒球コロニー刺激因子(G-CSF)の使用が必要となることがある。動物実験でのみ指摘されている妊孕性や発がん性に関する長期的な問題は解決されていない。そのため、使用には慎重を期すべき薬剤に変わりはない。
 参考文献
参考文献[1] Kobayashi Y, Morioka I, Koda T, Nakamachi Y, Okazaki Y, Noguchi Y, Ogi M, Chikahira M, Tanimura K, Ebina Y, Funakoshi T, Ohashi M, Iijima K, Inoue N, Kawano S, Yamada H. Low total IgM values and high cytomegalovirus loads in the blood of newborns with symptomatic congenital cytomegalovirus infection. J Perinat Med 43, 239-243, 2015
[2] Matsuo K, Morioka I, Oda M, Kobayashi Y, Nakamachi Y, Kawano S, Nagasaka M, Koda T, Yokota T, Morikawa S, Miwa A, Shibata A, Minematsu T, Inoue N, Yamada H, Iijima K. Quantitative evaluation of ventricular dilatation using computed tomography in infants with congenital cytomegalovirus infection. Brain Dev 36, 10-15, 2014
[3] Nishida K, Morioka I, Nakamachi Y, Kobayashi Y, Imanishi T, Kawano S, Iwatani S, Koda T, Deguchi M, Tanimura K, Yamashita D, Nibu K, Funakoshi T, Ohashi M, Inoue N, Iijima K, Yamada H. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment. Brain Dev 38, 209-216, 2016
トキソプラズマ妊婦スクリーニング
2017年3月27日
神戸大学大学院医学研究科 産科婦人科学分野 谷村憲司
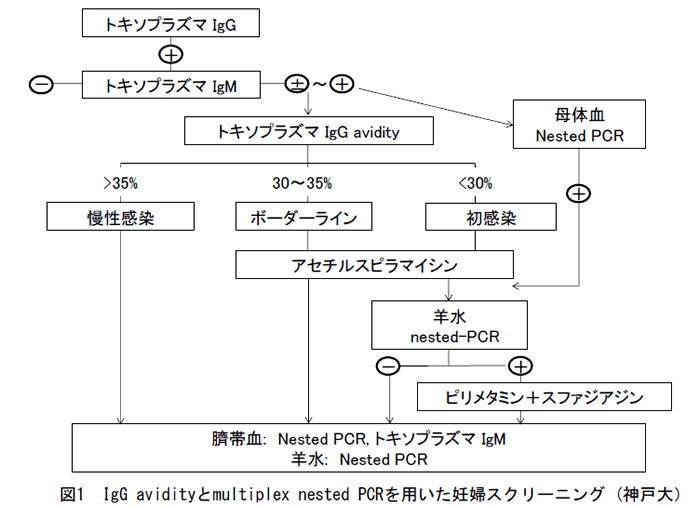
以前、我々は、母体血トキソプラズマIgG avidity index(AI)測定と羊水中トキソプラズマDNA multiplex nested PCR検査を用いた妊婦スクリーニング(図1)が先天性トキソプラズマ感染児の同定に有用と報告した[1]。この報告の中で、トキソプラズマHA検査陽性かつトキソプラズマIgMが疑陽性~陽性であった妊婦146人中、先天性トキソプラズマ感染は3人に認められ、その3人は全例がAI低値(<30%)かつ、羊水PCR陽性であった。したがって、羊水PCR陽性は先天性感染のハイリスク症例と考えられ、羊水PCR陽性を予測するのに最適なAI cutoff値を決定すべく前向き研究を行った[2]。
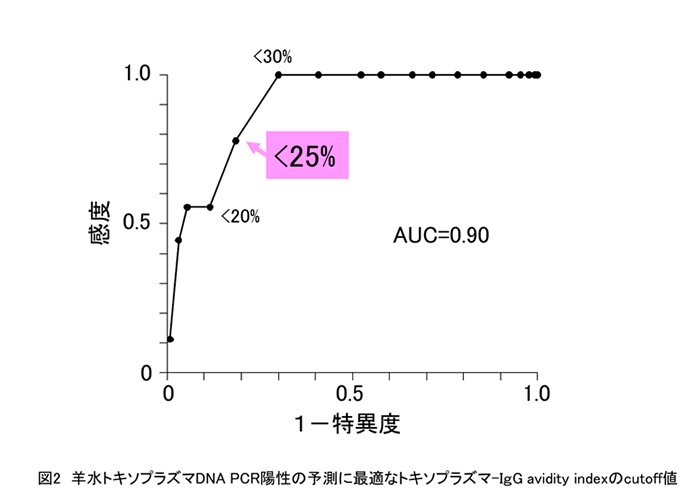
2005年~2014年に主に神戸大学とNTT東札幌病院を受診した妊婦で、トキソプラズマIgM疑陽性~陽性、かつ、妊娠中にIgG avidity検査と妊娠中もしくは分娩時に羊水PCR検査の両方を行った妊婦139名を対象とした。そのうち、3例に先天性感染を認めた。ROC解析により、羊水PCR陽性を予測するのに最適なAI cutoff値は<25 %で(図2)、羊水PCR陽性を予測する精度は、感度77.8 %、特異度81.5 %、陽性的中率22.6 %、陰性的中率98.1 %、正診率 81.3%であった。さらに、この研究期間中にAI?30%であった症例で、羊水PCR陽性、先天性感染のいずれも認めておらず、羊水PCR陽性を予測するAI cutoff値として25~30 %が有用である可能性を示した。
我々は、現在もトキソプラズマIgG, IgM, IgG avidity測定ならびにmultiplex nested PCR検査を用いた妊婦スクリーニング法と主にアセチルスピラマイシン母体投与による胎児感染予防法の有用性を前向き研究によって調べている(図1)。論文未発表データを紹介する。2004年10月から2016年11月までにトキソプラズマIgG陽性、IgM疑陽性~陽性で、かつ、avidity検査を受け、妊娠が帰結した母児は397組いる。出生児は、臨床所見、トキソプラズマIgM、PCR検査などで先天性感染の有無を診断し、PCR陽性の児は原則1歳までフォローアップした。 Avidity測定によって、初感染疑い(AI<30%)88人(22%)、中間域(30% < AI < 35%)29人(7%)で、既往感染(AI>35%)は280人(71%)であった。PCR陽性率は、出生前羊水12%(5/42人)、分娩時羊水9%(9/102人)、臍帯血3%(4/118人)であった。この期間中に7人(2%)の児が先天性感染と診断された。7人とも母親はAI<30%であり、AI?30%の母親から先天性感染は発生しなかった。1人は頭蓋内石灰化と羊水PCR陽性があり1年間治療を行った。1人は羊水PCR陽性で人工流産を選択した。1人は生後4ヶ月にIgMが陽性化した。他の4人は臍帯血PCR陽性で先天性感染と診断したが、生存の6人ともに現在(1歳2ケ月~11歳)のところ障害を認めていない。このことより、我々が行っているトキソプラズマの妊婦スクリーニングと母児感染予防法は、先天性感染児の発生を抑制し重症度を軽減する可能性があると考えられる。
 参考文献
参考文献[1] Yamada H, Nishikawa A, Yamamoto T, Mizue Y, Yamada T, Morizane M, Tairaku S, Nishihira J. Prospective study of congenital toxoplasmosis screening with use of IgG avidity and multiplex nested PCR methods. J Clin Microbiol 49, 2552-6, 2011
[2] Tanimura K, Nishikawa A, Tairaku S, Shinozaki N, Deguchi M, Morizane M, Ebina Y, Morioka I, Yamada H. The IgG avidity value for the prediction of Toxoplasma gondii infection in the amniotic fluid. J Infect Chemother 21, 668-671, 2015









