サイトメガロウイルス感染の検査
活動的なCMV感染は、ウイルス分離、CMV抗原血症(アンチゲネミア)、ウイルスDNAやRNAのPCRなどでの検出、細胞・組織病理学的な感染細胞の検出などをもって診断する。具体的な検査法は以下の通り。
1)ウイルス分離
検体としては、尿、咽頭拭い液、末梢血単核球(PBMC)、気管支肺胞洗浄(BAL)液、髄液などを用い、ヒト線維芽細胞(MRC5やヒト胎児肺線維芽細胞など:MRC5はATCCより購入可能)に検体を接種し、特徴的な細胞変性効果(cytopathic effect:CPE)の出現を確認する。ヒト胎児肺線維芽細胞の入手は困難にありつつあるが、テロメラーゼ遺伝子やヒトパピローマウイルスE6E7遺伝子を導入して不死化させたものを用いると、収量は落ちるが長期に培養可能なので便利である。
PCRによりウイルスゲノムを検出することが可能となった今日、ウイルス分離が必要となる局面は、抗ウイルス薬治療に伴い出現する可能性のある薬剤耐性を検査する薬剤感受性試験において、生きたウイルスが必要になることが稀にある程度にすぎない。CMVの場合、ゲノムDNAを有する全粒子の中で、感染性があるものは1000分の1以下、検体の保存などに問題がある場合などは10万分の1以下となる場合もあり、PCRで1万CMVコピー/mlであっても、ウイルス分離で陰性となってもおかしくはない。従って、PCRによるゲノム核酸の同定の方が感度の面でも優れている。
ウイルス分離のための検体に関することで重要なことは、1)目的に適した検体を採取すること、2)できる限り検体採取から培養細胞への接種までの時間を短くすること、3)凍結することなく、アイスパックなどで低温にして検査機関に送付することである。第1点目は、出生前の胎児感染の診断には羊水、先天性CMV感染の診断には、出生後3週間以内に採取された尿、神経学的症状を伴う場合に髄液、抗ウイルス薬投与が必要な症例では、PBMC、BALなど症状に合わせ採取する。なお、先天性感染の場合、髄液を検査することもあるが、比較的重篤な症候性の児を含め、これまでの研究班の経験ではCMVゲノムDNAでさえ検出されたことは無い。第3点目は、PCRを目的とする場合には、送付に当って凍結・冷蔵のいずれであっても、また、アイスパックを入れれば室温でも構わない。しかしながら、凍結・融解するとウイルスの活性が低下するため、ウイルス分離をするためには、冷蔵での送付が望まれる。現時点では、通常業務としてウイルス分離を実施する検査施設はないため、抗ウイルス薬治療などを実施することが予想される場合には、薬剤投与前に検体を採取し、血液以外の検体は、そのままの形で、血液についてはPBMCにして、-80C以下の超低温にて、薬剤治療が終わるまで保存する。この際、検体を1-2ml程度に分注しておくと、薬剤感受性を核酸配列レベルで検討する目的のものと核酸レベルで対応できない際のウイルス分離用にあてることができる。
実際のウイルス分離に当っては、増殖期にある細胞を接種時に80%程度のconfluencyとなるように培養プレートに捲き込み、半日から1日置いたところで、検体を接種直後に400 x gで30分遠心すると感染効率が上昇する(PBMCの場合には不要)。尿検体は採取の仕方によっては、細菌などが混入していることも珍しくないので、0.45µMのフィルターで濾過したものを接種する方が、安心である。接種1〜2時間後に培地を交換し、培養を開始する。症候性の先天性感染児の尿などウイルス量が特に多い場合には、検体の接種数日以内に細胞変性効果(CPE)を認める。症候性でなくても先天性感染児の尿を検体とした場合には、検体を接種した細胞の盲継代を1週間1回の頻度で2-3回行うと、CPEの出現を確認できる。なお、先天性感染でもPBMCや尿以外の検体を接種した場合や後天的感染や移植の場合には、盲継代を少なくとも数回は行う必要がある。CPEが出現しても他のウイルス感染の可能性がある場合には、感染培養細胞の免疫染色や感染細胞を含む培養液のPCRにより、CMVの抗原やDNAの検出を行い最終確定する。分離されたウイルスは、培養上清として、-80C以下の超低温で保存すると同時に、感染細胞も普通の細胞を保存する場合と同様に10%DMSOを添加して、-80C以下の超低温で保存する。感染細胞は、非感染細胞と混ぜて、ウイルスを大量に調製するために便利である。このように、ウイルス分離が実際に終了するには数週間を要する場合が多く、早期診断や先制治療による早期介入への利用価値は低い。
2)ウイルス迅速同定(シェルバイアル法)
尿、血液、BAL液などの検体を、スライドグラス上のヒト線維芽細胞に接種する。遠心し接種効率を高め、1~3日培養後、スライドを固定し、CMV抗原に対するモノクローナル抗体と反応させ、最終的にDABなどで染色する。迅速であること、BAL液を検体とした場合にCMV肺炎を診断できることがメリットであるが、血液検体などでのモニタリング目的には感度が低く薦められない。
3)CMV抗原血症検査(CMVアンチゲネミア法)
末梢血より分離した多形核白血球(好中球)を、スライド1枚に対して15万個サイトスピンによりスメアにしたものを用いて、CMVpp65抗原に対するモノクローナル抗体と反応させ、ペルオキシダーゼ法によりCMV抗原陽性細胞(多形核白血球)を検出する方法で、半日以内に結果が得られる。我国では、モノクローナル抗体の違いから、HRP-C7法とC10/11法があるが、同様な結果が得られる。移植におけるCMV感染診断の感度および特異性は高く(>85%)、一定量以上の陽性細胞検出でGCVなどの抗ウイルス薬投与を開始するpreemptive therapyの指標となっている。一方、欠点としては、末梢血中の多形核白血球が少ない場合には測定できず、感度も低下すること、目視で計数するため主観が入りこむ余地があること、固定法、染色法など微妙な条件設定の違いが影響する場合(例えば海外での治験結果との比較などで)があることに注意が必要である。先天性感染の場合、出生時に症候性でない場合には、血中のウイルス量は少なく、偽陰性となる可能性がある。なお、本検査は、コマーシャルラボで実施可能である。
4)定量PCR法
羊水、尿、血液、唾液、骨髄液、BAL液など各種の検体から、DNAを精製後、PCR増幅により定量的にCMVを検出できる。高い感度、特異性に加えて迅速に結果が得られる。欠点としては、血液検体を用いた場合に、活動性ではなく潜伏感染となっている極めて低コピー数の状態のウイルスDNAまでもが検出可能となるため、たとえ陽性の結果が出ても臨床的な意味付けが必要となってくることもある。そのため、血液の代わりに血漿を用いてCMV DNAを検出し活動的な感染を明らかにすることが多い。また、別の問題として、同一の検査会社を用いない限り施設間で異なる方法や定量標準を用いていることから、定量した実数値をそのまま比較はできない場合もあることがあげられる。定量標準は、WHOが2010年に行った国際標準品の制定作業により、試験法が異なっても一定の標準化が可能となったが、国内標準品の制定作業は、進んでいない。血漿を用いた定量PCR法とCMV抗原血症検査の比較試験は国内外で多数行われ、定量PCR法は、CMV抗原血症検査と同等もしくはそれ以上の感度・特異度があることが確立している。先天性 感染の場合、尿で100万〜1000万コピー/ml、血液で1000〜10万コピー/ml程度のウイルス量であることが一般的であり、苦労することなく、どの施設においても、容易に診断可能である。しかし、我国では先天性感染・移植などの現場において、定量PCR法に保険適用がないことから、CMV抗原血症検査が多用されている現状がある。核酸ベースの検査としては、活動性の感染時に発現するmRNAを検出するNASBA(nucleic acid sequence based amplification)法やTRC(transcription-reverse transcription Concerted reaction)法などもある。(詳細は、Inoue 2011)。
特殊な濾紙に尿や唾液検体を採取し、濾紙片をそのままリアルタイムPCRに供することもできる(Nozawa et al. 2007)が、感度が、精製したDNAを用いた場合の10〜15%程度であるため、多数の検体から陽性のものをスクリーニングすることなどに、この方法は適する(Koyano et al., 2011)が、半定量的な結果しか得られないため、個別の症例への対応には向かない。
先天性CMV感染の確定診断には、生後3週以内の尿を用いるのが一般的である。しかし、この時期を逃した場合や神経学的障害の原因探索のためには、乾燥臍帯を用いることができる(Ogawa et al. 2008)。乾燥臍帯を検体とし、市販のDNA精製キットを用いてDNAを精製する場合には、1)Proteaseの反応を長くすること、2)検体量を入れすぎないこと(20-30mgで十分)、3)臍帯の乾燥のために塗されている吸湿剤などを入れないようにすることが重要である。また、実際の測定にあたっては、1)細胞遺伝子の定量も陽性コントロールとして行うこと、2)精製DNAの希釈系列を置くこと、によって非特異的な反応阻害が起こっていないことを確認すること、が求められる。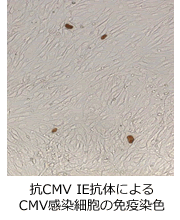
5)細胞・組織病理学的検査
組織標本やBAL液において巨細胞核内封入体を有する細胞を検出する。抗CMVモノクローナル抗体を用いた免疫組織染色法でCMV抗原を検出し最終確定することが望ましい。病院検査部の病理担当者と相談することが早道である。
 参考文献
参考文献
Fukui Y, Shindoh K, Yamamoto Y, Koyano S, Kosugi I, Yamaguchi T, Kurane I, Inoue N. Establishment of a cell-based assay for screening of compounds inhibiting very early events in cytomegalovirus replication cycle and characterization of a compound identified using the assay. Antimicrob. Agents Chemother 52:2420-2427, 2008.
Inoue N. Chapter 84 Human herpesvirus 5 (cytomegalovirus), pp. In: (Ed) Liu D, “Molecular detection of human viral pathogens” Taylor & Francis CRC Press, 2011.
Koyano S, Inoue N, Oka A, Moriuchi H, Asano K, Ito Y, Yamada H, Yoshikawa T, Suzutani T, for the Japanese Congenital Cytomegalovirus Study Group. Screening for congenital cytomegalovirus infection using newborn urine samples collected on filter paper: feasibility and outcomes from a multi-centre study. BMJ Open 1:e000118, 2011.
Nozawa N, Koyano S, Yamamoto Y, Inami Y, Kurane I, Inoue N. Real-time PCR assay using specimens on filter disks as a template for detection of cytomegalovirus in urine specimens. J. Clin. Microbiol. 45:1305-1307, 2007.
Ogawa H, Suzutani T, Baba Y, Koyano S, Nozawa N, Ishibashi K, Fujieda K, Inoue N, Omori K. Etiology of severe sensorineural hearing loss in children: independent impact of congenital cytomegalovirus infection and GJB2 mutations. J. Infect. Dis. 195:782-788, 2007.
Scott GM, Isaacs MA, Zeng F, Kesson AM, Rawlinson WD. Cytomegalovirus antiviral resistance associated with treatment induced UL97 (protein kinase) and UL54 (DNA polymerase) mutations J. Med. Virol. 74:85-93, 2004.
担当
国立感染症研究所 ウイルス第1部・第4室 井上直樹
1)ウイルス分離
検体としては、尿、咽頭拭い液、末梢血単核球(PBMC)、気管支肺胞洗浄(BAL)液、髄液などを用い、ヒト線維芽細胞(MRC5やヒト胎児肺線維芽細胞など:MRC5はATCCより購入可能)に検体を接種し、特徴的な細胞変性効果(cytopathic effect:CPE)の出現を確認する。ヒト胎児肺線維芽細胞の入手は困難にありつつあるが、テロメラーゼ遺伝子やヒトパピローマウイルスE6E7遺伝子を導入して不死化させたものを用いると、収量は落ちるが長期に培養可能なので便利である。
PCRによりウイルスゲノムを検出することが可能となった今日、ウイルス分離が必要となる局面は、抗ウイルス薬治療に伴い出現する可能性のある薬剤耐性を検査する薬剤感受性試験において、生きたウイルスが必要になることが稀にある程度にすぎない。CMVの場合、ゲノムDNAを有する全粒子の中で、感染性があるものは1000分の1以下、検体の保存などに問題がある場合などは10万分の1以下となる場合もあり、PCRで1万CMVコピー/mlであっても、ウイルス分離で陰性となってもおかしくはない。従って、PCRによるゲノム核酸の同定の方が感度の面でも優れている。
ウイルス分離のための検体に関することで重要なことは、1)目的に適した検体を採取すること、2)できる限り検体採取から培養細胞への接種までの時間を短くすること、3)凍結することなく、アイスパックなどで低温にして検査機関に送付することである。第1点目は、出生前の胎児感染の診断には羊水、先天性CMV感染の診断には、出生後3週間以内に採取された尿、神経学的症状を伴う場合に髄液、抗ウイルス薬投与が必要な症例では、PBMC、BALなど症状に合わせ採取する。なお、先天性感染の場合、髄液を検査することもあるが、比較的重篤な症候性の児を含め、これまでの研究班の経験ではCMVゲノムDNAでさえ検出されたことは無い。第3点目は、PCRを目的とする場合には、送付に当って凍結・冷蔵のいずれであっても、また、アイスパックを入れれば室温でも構わない。しかしながら、凍結・融解するとウイルスの活性が低下するため、ウイルス分離をするためには、冷蔵での送付が望まれる。現時点では、通常業務としてウイルス分離を実施する検査施設はないため、抗ウイルス薬治療などを実施することが予想される場合には、薬剤投与前に検体を採取し、血液以外の検体は、そのままの形で、血液についてはPBMCにして、-80C以下の超低温にて、薬剤治療が終わるまで保存する。この際、検体を1-2ml程度に分注しておくと、薬剤感受性を核酸配列レベルで検討する目的のものと核酸レベルで対応できない際のウイルス分離用にあてることができる。
実際のウイルス分離に当っては、増殖期にある細胞を接種時に80%程度のconfluencyとなるように培養プレートに捲き込み、半日から1日置いたところで、検体を接種直後に400 x gで30分遠心すると感染効率が上昇する(PBMCの場合には不要)。尿検体は採取の仕方によっては、細菌などが混入していることも珍しくないので、0.45µMのフィルターで濾過したものを接種する方が、安心である。接種1〜2時間後に培地を交換し、培養を開始する。症候性の先天性感染児の尿などウイルス量が特に多い場合には、検体の接種数日以内に細胞変性効果(CPE)を認める。症候性でなくても先天性感染児の尿を検体とした場合には、検体を接種した細胞の盲継代を1週間1回の頻度で2-3回行うと、CPEの出現を確認できる。なお、先天性感染でもPBMCや尿以外の検体を接種した場合や後天的感染や移植の場合には、盲継代を少なくとも数回は行う必要がある。CPEが出現しても他のウイルス感染の可能性がある場合には、感染培養細胞の免疫染色や感染細胞を含む培養液のPCRにより、CMVの抗原やDNAの検出を行い最終確定する。分離されたウイルスは、培養上清として、-80C以下の超低温で保存すると同時に、感染細胞も普通の細胞を保存する場合と同様に10%DMSOを添加して、-80C以下の超低温で保存する。感染細胞は、非感染細胞と混ぜて、ウイルスを大量に調製するために便利である。このように、ウイルス分離が実際に終了するには数週間を要する場合が多く、早期診断や先制治療による早期介入への利用価値は低い。
2)ウイルス迅速同定(シェルバイアル法)
尿、血液、BAL液などの検体を、スライドグラス上のヒト線維芽細胞に接種する。遠心し接種効率を高め、1~3日培養後、スライドを固定し、CMV抗原に対するモノクローナル抗体と反応させ、最終的にDABなどで染色する。迅速であること、BAL液を検体とした場合にCMV肺炎を診断できることがメリットであるが、血液検体などでのモニタリング目的には感度が低く薦められない。
3)CMV抗原血症検査(CMVアンチゲネミア法)
末梢血より分離した多形核白血球(好中球)を、スライド1枚に対して15万個サイトスピンによりスメアにしたものを用いて、CMVpp65抗原に対するモノクローナル抗体と反応させ、ペルオキシダーゼ法によりCMV抗原陽性細胞(多形核白血球)を検出する方法で、半日以内に結果が得られる。我国では、モノクローナル抗体の違いから、HRP-C7法とC10/11法があるが、同様な結果が得られる。移植におけるCMV感染診断の感度および特異性は高く(>85%)、一定量以上の陽性細胞検出でGCVなどの抗ウイルス薬投与を開始するpreemptive therapyの指標となっている。一方、欠点としては、末梢血中の多形核白血球が少ない場合には測定できず、感度も低下すること、目視で計数するため主観が入りこむ余地があること、固定法、染色法など微妙な条件設定の違いが影響する場合(例えば海外での治験結果との比較などで)があることに注意が必要である。先天性感染の場合、出生時に症候性でない場合には、血中のウイルス量は少なく、偽陰性となる可能性がある。なお、本検査は、コマーシャルラボで実施可能である。
4)定量PCR法
羊水、尿、血液、唾液、骨髄液、BAL液など各種の検体から、DNAを精製後、PCR増幅により定量的にCMVを検出できる。高い感度、特異性に加えて迅速に結果が得られる。欠点としては、血液検体を用いた場合に、活動性ではなく潜伏感染となっている極めて低コピー数の状態のウイルスDNAまでもが検出可能となるため、たとえ陽性の結果が出ても臨床的な意味付けが必要となってくることもある。そのため、血液の代わりに血漿を用いてCMV DNAを検出し活動的な感染を明らかにすることが多い。また、別の問題として、同一の検査会社を用いない限り施設間で異なる方法や定量標準を用いていることから、定量した実数値をそのまま比較はできない場合もあることがあげられる。定量標準は、WHOが2010年に行った国際標準品の制定作業により、試験法が異なっても一定の標準化が可能となったが、国内標準品の制定作業は、進んでいない。血漿を用いた定量PCR法とCMV抗原血症検査の比較試験は国内外で多数行われ、定量PCR法は、CMV抗原血症検査と同等もしくはそれ以上の感度・特異度があることが確立している。先天性 感染の場合、尿で100万〜1000万コピー/ml、血液で1000〜10万コピー/ml程度のウイルス量であることが一般的であり、苦労することなく、どの施設においても、容易に診断可能である。しかし、我国では先天性感染・移植などの現場において、定量PCR法に保険適用がないことから、CMV抗原血症検査が多用されている現状がある。核酸ベースの検査としては、活動性の感染時に発現するmRNAを検出するNASBA(nucleic acid sequence based amplification)法やTRC(transcription-reverse transcription Concerted reaction)法などもある。(詳細は、Inoue 2011)。
特殊な濾紙に尿や唾液検体を採取し、濾紙片をそのままリアルタイムPCRに供することもできる(Nozawa et al. 2007)が、感度が、精製したDNAを用いた場合の10〜15%程度であるため、多数の検体から陽性のものをスクリーニングすることなどに、この方法は適する(Koyano et al., 2011)が、半定量的な結果しか得られないため、個別の症例への対応には向かない。
先天性CMV感染の確定診断には、生後3週以内の尿を用いるのが一般的である。しかし、この時期を逃した場合や神経学的障害の原因探索のためには、乾燥臍帯を用いることができる(Ogawa et al. 2008)。乾燥臍帯を検体とし、市販のDNA精製キットを用いてDNAを精製する場合には、1)Proteaseの反応を長くすること、2)検体量を入れすぎないこと(20-30mgで十分)、3)臍帯の乾燥のために塗されている吸湿剤などを入れないようにすることが重要である。また、実際の測定にあたっては、1)細胞遺伝子の定量も陽性コントロールとして行うこと、2)精製DNAの希釈系列を置くこと、によって非特異的な反応阻害が起こっていないことを確認すること、が求められる。

5)細胞・組織病理学的検査
組織標本やBAL液において巨細胞核内封入体を有する細胞を検出する。抗CMVモノクローナル抗体を用いた免疫組織染色法でCMV抗原を検出し最終確定することが望ましい。病院検査部の病理担当者と相談することが早道である。
 参考文献
参考文献Fukui Y, Shindoh K, Yamamoto Y, Koyano S, Kosugi I, Yamaguchi T, Kurane I, Inoue N. Establishment of a cell-based assay for screening of compounds inhibiting very early events in cytomegalovirus replication cycle and characterization of a compound identified using the assay. Antimicrob. Agents Chemother 52:2420-2427, 2008.
Inoue N. Chapter 84 Human herpesvirus 5 (cytomegalovirus), pp. In: (Ed) Liu D, “Molecular detection of human viral pathogens” Taylor & Francis CRC Press, 2011.
Koyano S, Inoue N, Oka A, Moriuchi H, Asano K, Ito Y, Yamada H, Yoshikawa T, Suzutani T, for the Japanese Congenital Cytomegalovirus Study Group. Screening for congenital cytomegalovirus infection using newborn urine samples collected on filter paper: feasibility and outcomes from a multi-centre study. BMJ Open 1:e000118, 2011.
Nozawa N, Koyano S, Yamamoto Y, Inami Y, Kurane I, Inoue N. Real-time PCR assay using specimens on filter disks as a template for detection of cytomegalovirus in urine specimens. J. Clin. Microbiol. 45:1305-1307, 2007.
Ogawa H, Suzutani T, Baba Y, Koyano S, Nozawa N, Ishibashi K, Fujieda K, Inoue N, Omori K. Etiology of severe sensorineural hearing loss in children: independent impact of congenital cytomegalovirus infection and GJB2 mutations. J. Infect. Dis. 195:782-788, 2007.
Scott GM, Isaacs MA, Zeng F, Kesson AM, Rawlinson WD. Cytomegalovirus antiviral resistance associated with treatment induced UL97 (protein kinase) and UL54 (DNA polymerase) mutations J. Med. Virol. 74:85-93, 2004.
担当
国立感染症研究所 ウイルス第1部・第4室 井上直樹









