新生児の治療
CMVに対する抗ウイルス薬治療
1)CMVに対する薬剤
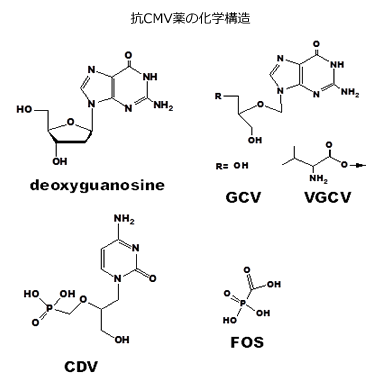 ガンシクロビル、バルガンシクロビル:
ガンシクロビル、バルガンシクロビル:
ガンシクロビル(GCV、デノシン®)は、アシクロビル(ACV)と類似した薬剤として開発されたデオキシグアノシンのデオキシリボースの2’を削ったものである。経口GCVの生体内利用率はわずか6〜9%である。このため、バリンエステル化されたプロドラッグとして、生体内利用率の高めたのがバルガンシクロビル(VGCV、バリキサ®)である。GCV及びVGCVは、全てのヘルペスウイルスに対して活性を有するが、CMVではウイルスがコードするUL97プロテインキナーゼによって一リン酸化され、ACV同様に細胞の酵素によって二リン酸、三リン酸化され、ウイルスDNAポリメラーゼを競合的に阻害しウイルスDNA複製を阻害する。GCVの副作用は強く、骨髄抑制(特に好中球減少)の他、動物実験で催奇形性、精子形成の低下、発癌性があることが明らかとなっている。重度の好中球減少(500/μL未満)の場合は、顆粒球コロニー刺激因子または顆粒球マクロファージコロニー刺激因子を使った骨髄刺激、または薬物投与の中断が必要となる。比較的まれな有害作用としては、発疹、発熱、窒素血症、肝機能障害、悪心、および嘔吐がある。
ホスカルネット:
ホスカルネット(FOS、ホスカビル®)は、無機ピロリン酸の有機類似物質であり、細胞内でリン酸化されることなく、特異的にウイルスのDNAポリメラーゼのピロリン酸結合部位に直接作用し、その活性を抑制して抗ウイルス効果を示す。GCV耐性株に対しても有効である。点滴静注用ホスカビル注24mg/mLの製造販売承認事項一部変更承認により、造血幹細胞移植患者におけるCMV血症及び感染症が適応に追加された。造血幹細胞移植において、臍帯血移植におけるHHV6関連脳症の発症頻度が明らかに高率であることから、リスクの高い期間に限ってFOSなどの抗ヘルペス薬の予防投与する、ないしは早期介入が可能となるようなモニタリングを行いFOSのpreemptive投与が検討されている。腎毒性をはじめ、GCV以上に強い毒性がある。先天性CMV感染での使用報告は、ほとんどない。
シドフォビル:
シドフォビル(CDV)は、長時間作用性のヌクレオチド類似物質で,ヘルペスウイルス科のみならず,アデノウイルス,ヒトパピローマウイルス、ヒトポリオーマウイルスなどのDNAウイルスの複製を阻害する。CDVは、GCV耐性株に対しても有効である。CDVは、GCV耐性出現に際してFOSが使用できない場合に有用と考えられているが、我国においては未承認であるため、幅広い適応についての検討はなされていない。副作用としては、腎障害、好中球減少などがある。シドフォビルのプロドラッグが現在、臨床試験中となっている。
いずれにしても、既存の抗CMV薬は、細胞中の「おとなしくしている」ウイルスを除去するわけではないため、一過性の封じ込め策である一方、骨髄抑制や腎毒性などの副反応と無縁ではないことを理解して治療にあたることが重要である。
2)CMVのGCV/VGCV感受性試験
GCVやVGCV耐性のCMV株が出現してくる頻度は低い。宿主の免疫の状態によって耐性ウイルスの出現率は異なり、心臓移植や腹部の臓器移植(肝臓など)では1.5〜2%、肺移植で5〜9%である。先天性感染児でのGCV耐性株分離の報告は現時点ではなく、1死亡症例の検体をpyrosequencingで解析したところ耐性変異が11〜17%出現してきていることが知られているのみである。CMVに対するGCVの効き方は、HSVに対するACVの効き方に比べ緩やかであり、時として、即効性が見られないことから耐性株が出現した可能性があると思われがちであるが、こうした症例をこれまでに多数経験してきたが、投与後2週間もすれば次第に効果が明確になる場合に多く、耐性によるものであることは、まずない。ACVに比してGCV耐性の頻度が低いのは、GCVの一リン酸化に必要なUL97がCMVの増殖に必須であるため、耐性であるが増殖性に影響を与えないような変異は限られているためと考えられる。
CMVは、ウイルス分離に2〜3週程度を要する場合も多く、生物学的方法でGCV耐性か感受性かを決めるのは、相当の手間と時間がかかり、臨床的対応が困難となる。また、ウイルス分離を業務として実施する施設もない。このため、耐性変異が知られるUL97及びポリメラーゼ遺伝子の特定の領域を解析するのが簡便かつ現実的である(必要なプライマーなどの条件:Scott et al., 2004)。決定した塩基配列を張り付ければ、既知の耐性変異が存在するかを解析できる便利なwebサイト(www.informatik.uni-ulm.de/ni/mitarbeiter/HKestler/hcmv/)もある。変異があるが既知置換が報告されておらず生物学的方法による検討が必要な場合には、凍結保存しておいた薬剤投与前の検体及び薬剤投与中の検体からウイルス分離を試み、CPEが見えだした頃合いをみて、多様な濃度のGCV存在下に非感染細胞に感染細胞を接種し、2〜3日後に市販のIE2に対する抗体(Mab810, Millipore)で免疫染色すると感受性であるか大まかに判定できる。感受性試験にはCMV力価を迅速に決定できるレポーター細胞(Fukui et al. 2008) などを用いて検討する方法も考案されている。
近年、検体の種類(髄液、唾液、血液、尿など)によりウイルス株が薬剤感受性であるか耐性であるかが異なるcompartmentalizationと呼ばれる現象が報告されてきているため、病態を反映すると思われる検体中に耐性株が出現したのかどうかを解析しないと、薬剤感受性試験の臨床的な意義がなくなることがあるので注意を要する。
 ガンシクロビル、バルガンシクロビル:
ガンシクロビル、バルガンシクロビル:ガンシクロビル(GCV、デノシン®)は、アシクロビル(ACV)と類似した薬剤として開発されたデオキシグアノシンのデオキシリボースの2’を削ったものである。経口GCVの生体内利用率はわずか6〜9%である。このため、バリンエステル化されたプロドラッグとして、生体内利用率の高めたのがバルガンシクロビル(VGCV、バリキサ®)である。GCV及びVGCVは、全てのヘルペスウイルスに対して活性を有するが、CMVではウイルスがコードするUL97プロテインキナーゼによって一リン酸化され、ACV同様に細胞の酵素によって二リン酸、三リン酸化され、ウイルスDNAポリメラーゼを競合的に阻害しウイルスDNA複製を阻害する。GCVの副作用は強く、骨髄抑制(特に好中球減少)の他、動物実験で催奇形性、精子形成の低下、発癌性があることが明らかとなっている。重度の好中球減少(500/μL未満)の場合は、顆粒球コロニー刺激因子または顆粒球マクロファージコロニー刺激因子を使った骨髄刺激、または薬物投与の中断が必要となる。比較的まれな有害作用としては、発疹、発熱、窒素血症、肝機能障害、悪心、および嘔吐がある。
ホスカルネット:
ホスカルネット(FOS、ホスカビル®)は、無機ピロリン酸の有機類似物質であり、細胞内でリン酸化されることなく、特異的にウイルスのDNAポリメラーゼのピロリン酸結合部位に直接作用し、その活性を抑制して抗ウイルス効果を示す。GCV耐性株に対しても有効である。点滴静注用ホスカビル注24mg/mLの製造販売承認事項一部変更承認により、造血幹細胞移植患者におけるCMV血症及び感染症が適応に追加された。造血幹細胞移植において、臍帯血移植におけるHHV6関連脳症の発症頻度が明らかに高率であることから、リスクの高い期間に限ってFOSなどの抗ヘルペス薬の予防投与する、ないしは早期介入が可能となるようなモニタリングを行いFOSのpreemptive投与が検討されている。腎毒性をはじめ、GCV以上に強い毒性がある。先天性CMV感染での使用報告は、ほとんどない。
シドフォビル:
シドフォビル(CDV)は、長時間作用性のヌクレオチド類似物質で,ヘルペスウイルス科のみならず,アデノウイルス,ヒトパピローマウイルス、ヒトポリオーマウイルスなどのDNAウイルスの複製を阻害する。CDVは、GCV耐性株に対しても有効である。CDVは、GCV耐性出現に際してFOSが使用できない場合に有用と考えられているが、我国においては未承認であるため、幅広い適応についての検討はなされていない。副作用としては、腎障害、好中球減少などがある。シドフォビルのプロドラッグが現在、臨床試験中となっている。
いずれにしても、既存の抗CMV薬は、細胞中の「おとなしくしている」ウイルスを除去するわけではないため、一過性の封じ込め策である一方、骨髄抑制や腎毒性などの副反応と無縁ではないことを理解して治療にあたることが重要である。
2)CMVのGCV/VGCV感受性試験
GCVやVGCV耐性のCMV株が出現してくる頻度は低い。宿主の免疫の状態によって耐性ウイルスの出現率は異なり、心臓移植や腹部の臓器移植(肝臓など)では1.5〜2%、肺移植で5〜9%である。先天性感染児でのGCV耐性株分離の報告は現時点ではなく、1死亡症例の検体をpyrosequencingで解析したところ耐性変異が11〜17%出現してきていることが知られているのみである。CMVに対するGCVの効き方は、HSVに対するACVの効き方に比べ緩やかであり、時として、即効性が見られないことから耐性株が出現した可能性があると思われがちであるが、こうした症例をこれまでに多数経験してきたが、投与後2週間もすれば次第に効果が明確になる場合に多く、耐性によるものであることは、まずない。ACVに比してGCV耐性の頻度が低いのは、GCVの一リン酸化に必要なUL97がCMVの増殖に必須であるため、耐性であるが増殖性に影響を与えないような変異は限られているためと考えられる。
CMVは、ウイルス分離に2〜3週程度を要する場合も多く、生物学的方法でGCV耐性か感受性かを決めるのは、相当の手間と時間がかかり、臨床的対応が困難となる。また、ウイルス分離を業務として実施する施設もない。このため、耐性変異が知られるUL97及びポリメラーゼ遺伝子の特定の領域を解析するのが簡便かつ現実的である(必要なプライマーなどの条件:Scott et al., 2004)。決定した塩基配列を張り付ければ、既知の耐性変異が存在するかを解析できる便利なwebサイト(www.informatik.uni-ulm.de/ni/mitarbeiter/HKestler/hcmv/)もある。変異があるが既知置換が報告されておらず生物学的方法による検討が必要な場合には、凍結保存しておいた薬剤投与前の検体及び薬剤投与中の検体からウイルス分離を試み、CPEが見えだした頃合いをみて、多様な濃度のGCV存在下に非感染細胞に感染細胞を接種し、2〜3日後に市販のIE2に対する抗体(Mab810, Millipore)で免疫染色すると感受性であるか大まかに判定できる。感受性試験にはCMV力価を迅速に決定できるレポーター細胞(Fukui et al. 2008) などを用いて検討する方法も考案されている。
近年、検体の種類(髄液、唾液、血液、尿など)によりウイルス株が薬剤感受性であるか耐性であるかが異なるcompartmentalizationと呼ばれる現象が報告されてきているため、病態を反映すると思われる検体中に耐性株が出現したのかどうかを解析しないと、薬剤感受性試験の臨床的な意義がなくなることがあるので注意を要する。
先天性CMV感染症に対する抗ウイルス薬治療の実際
症候性の先天性CMV感染では、出生時には症状がすでに固定されており、出生後の治療は効果がないと考えられていた。しかしながら、Kimberlinらが2003年に症候性の先天性CMV感染の新生児を対象とし、無治療とGCV静注6週間を比較したrandomized control trialにて、GCV治療による難聴の改善効果を報告して以来、症候性先天性CMV感染症に対して積極的な治療が行われるようになってきた。ただし、GCVやVGCVは投与により好中球減少、ホスカルネットは腎機能障害などの副作用が懸念される薬剤であるため、現時点では症候性感染症で、投与のメリットが副作用などのデメリットを上回ると判断された症例に対してのみ、治療が行われているのが現状である。いずれの薬剤も現状では先天性CMV感染への保険適用はないため、十分なインフォームドコンセントを行い承諾が得られた後に使用する。以下のプロトコールを参考にする。
厚生労働省研究班で作成した治療プロトコール(小児感染免疫,22,385-9,2010)
【対 象】
症候性先天性CMV感染児で、以下のすべてを満たすこと。
(1)治療開始時点で原則として生後30日以内
(2)治療開始時点の体重が 1,200 g以上
(3)治療開始時点での修正在胎週数32週以上
除外項目:
(1)VGCVの投与に関しては、薬物の吸収に支障をきたすような消化管障害の存在または既往
(例えば壊死性腸炎)
(2)クレアチニン >1.5 mg/mLまたはCCr(10 mL/min/1.73 m2)
(3)VGCVまたはGCVによる治療の実施が困難となるような他の重症疾患を有する場合
注1)「症候性」には
・中枢神経系障害:(1)小頭症、(2)脳の画像異常、(3)脳脊髄液(CSF)検査値異常、(4)脈絡網膜炎、(5)聴力障害、(6)CSFよりCMV-DNAを検出
・中枢神経系外障害:(1)血小板減少、(2)紫斑、(3)肝腫大、(4)脾腫、(5)子宮内発育遅滞、(6)肝炎
を含む。ただし、各項目の重症度からみた「症候性」の定義はまだ明確ではなく、例えば「脳の画像異常」についてもどこまでを含むのかについてはコンセンサスが得られていない。
注2)治療開始時点で生後30日以内であることを明示しているが、ここではあくまでも「原則」としており、主治医の判断でこの時期を過ぎても適応可能とした。
【治療方法】
VGCV経口投与(授乳後) 16 mg/kg/回 x 2回/日 x 6週間
または GCV点滴静注 6 mg/kg/回 x 2回/日 x 6週間
注3)いずれの薬剤も先天性CMV感染に対しては保険適応がない。どちらの薬剤を選択するかは主治医と家族との話合いで個々に決めて行くが、重症例や消化管障害がある場合では GCVの使用を優先して考える。
注4)VALIXA(バリキサ)錠(バルカンシクロビル塩酸塩製剤)はフィルムコーティングしてあるが、 乳児への投与はこれを砕いて調整することになる(懸濁液として供与することを推奨する)。1錠(重さ 620 mg)中に 450 mgのVGCVを含むので、 VGCV 16 mg/kg はバリキサ錠粉砕粒 22 mg/kgに相当する。
注5)バリキサ錠の価格は、1錠 2,942.90円である。体重6 kgの児の場合は上記用量で 6週間使用した場合のコストは 54,934円になる。一方デノシン点滴静注の 500 mgバイアルの価格は 13,718円であり、バイアル内では注射用水で溶解後24時間は安定しているので、1日に 1バイアル使用するとして、6週間使用した場合のコストは 576,156円になる。
【効果判定 および 副作用評価】
1. ウイルス量
測定法:real-time PCR
検体:(1) 全血と尿、(2) 髄液
測定時期:(1) 治療前に最低1回、できれば2回(無治療での変動の有無をみるため)。その後治療中と治療終了後最低 2週間までの間は、週1回チェック。できれば治療の継続(追加治療プロトコール参照)の有無に関わらず、投与開始から24週間(6カ月)の時点でもチェックする。
(2) 治療前に1回施行し、CMV DNAが検出された場合は治療開始後2週間の時点でもう1回、その段階でもCMV DNAが検出されたら治療終了後2週間の時点でもう1回チェックする。できればCMV DNAの検出の有無に関わらず、そして治療の継続の有無に関わらず投与開始から24週間(6カ月)の時点でもチェックする。
注6)血液採取にあたってヘパリンが混入するとPCRが阻害されるので加えてはならない。
注7)髄液の採取は困難な場合も多いが、その機会があれば、ウイルス量の定量に加えて、圧測定、外観観察、細胞数と分画、蛋白定量、糖定量を行う。初回の髄液でCMV DNAが検出されなかった場合には、臨床的に中枢神経系病変の増悪が疑われない限りその後の検査は不要である。
2.ウイルス分離と薬剤感受性試験(または薬剤感受性関連遺伝子配列の解析)
採取時期:治療前。治療の各クール終了後に再燃が見られたらその都度。
検体:尿、血液
3.GCV血中濃度
測定時期:第5治療日(± 1日)に実施。VGCV投与後、30分(15-45分)、90分(1-3時間)、6時間(5-7時間)、11時間(10-12時間)の4回採血(血清または血漿として最低0.2 mL)。困難であれば、90分(1-3時間)(予想Cmax)と11時間(10-12時間)(次回投与の直前;Cmin)の2回。
測定法:液体クロマトグラフィー/タンデムマススペクトロメトリー法。
4.聴力検査
実施時期:治療前、治療開始後 6週間、6カ月、1年、2年の 5回実施。困難であれば、治療前と治療開始後 6カ月の2回実施。
測定法:聴性脳幹反応(ABR)
5.眼底検査
実施時期:治療前と治療開始後 6カ月の 2回。ただし治療前に異常が認められた場合には、適宜フォローする。
6.発達評価
評価時期・方法:通常の乳幼児検診の key months(修正4カ月、7カ月、10カ月、18カ月、3歳半など)に遠城寺式(18か月頃まで)または新版K式発達検査(2歳以降)を行い、DQを算定する。
7.脳画像評価
評価時期:治療前と治療開始後 6カ月の 2回。18カ月〜2歳頃にも追跡調査を行うことを推奨する。
評価法:MRI(FLAIRや拡散強調画像も含む)を原則とする。ただし鎮静等の問題でどうしても実施困難な場合はCTを施行する。
8. 副作用チェック
最低測定項目:CBC/diff, ALT, 総ビリルビン、尿酸、クレアチニン
測定時期:治療前に1回、その後治療中と治療終了後最低 2週間までの間は週1回チェック。
注8)grade 2以上の副反応が出現したら、原則投与中止とする。
注9)好中球減少に関しては、500/µL未満になったらいったん中止して >750/µLになるまで待ってfull doseで再開する。再び 好中球数が500/µL未満となったら、50% doseにして >500/µLとなるのを待つ。この用量で好中球数の上昇が認められなければ投与中止とする1)。
症候性先天性CMV感染児で、以下のすべてを満たすこと。
(1)治療開始時点で原則として生後30日以内
(2)治療開始時点の体重が 1,200 g以上
(3)治療開始時点での修正在胎週数32週以上
除外項目:
(1)VGCVの投与に関しては、薬物の吸収に支障をきたすような消化管障害の存在または既往
(例えば壊死性腸炎)
(2)クレアチニン >1.5 mg/mLまたはCCr(10 mL/min/1.73 m2)
(3)VGCVまたはGCVによる治療の実施が困難となるような他の重症疾患を有する場合
注1)「症候性」には
・中枢神経系障害:(1)小頭症、(2)脳の画像異常、(3)脳脊髄液(CSF)検査値異常、(4)脈絡網膜炎、(5)聴力障害、(6)CSFよりCMV-DNAを検出
・中枢神経系外障害:(1)血小板減少、(2)紫斑、(3)肝腫大、(4)脾腫、(5)子宮内発育遅滞、(6)肝炎
を含む。ただし、各項目の重症度からみた「症候性」の定義はまだ明確ではなく、例えば「脳の画像異常」についてもどこまでを含むのかについてはコンセンサスが得られていない。
注2)治療開始時点で生後30日以内であることを明示しているが、ここではあくまでも「原則」としており、主治医の判断でこの時期を過ぎても適応可能とした。
【治療方法】
VGCV経口投与(授乳後) 16 mg/kg/回 x 2回/日 x 6週間
または GCV点滴静注 6 mg/kg/回 x 2回/日 x 6週間
注3)いずれの薬剤も先天性CMV感染に対しては保険適応がない。どちらの薬剤を選択するかは主治医と家族との話合いで個々に決めて行くが、重症例や消化管障害がある場合では GCVの使用を優先して考える。
注4)VALIXA(バリキサ)錠(バルカンシクロビル塩酸塩製剤)はフィルムコーティングしてあるが、 乳児への投与はこれを砕いて調整することになる(懸濁液として供与することを推奨する)。1錠(重さ 620 mg)中に 450 mgのVGCVを含むので、 VGCV 16 mg/kg はバリキサ錠粉砕粒 22 mg/kgに相当する。
注5)バリキサ錠の価格は、1錠 2,942.90円である。体重6 kgの児の場合は上記用量で 6週間使用した場合のコストは 54,934円になる。一方デノシン点滴静注の 500 mgバイアルの価格は 13,718円であり、バイアル内では注射用水で溶解後24時間は安定しているので、1日に 1バイアル使用するとして、6週間使用した場合のコストは 576,156円になる。
【効果判定 および 副作用評価】
1. ウイルス量
測定法:real-time PCR
検体:(1) 全血と尿、(2) 髄液
測定時期:(1) 治療前に最低1回、できれば2回(無治療での変動の有無をみるため)。その後治療中と治療終了後最低 2週間までの間は、週1回チェック。できれば治療の継続(追加治療プロトコール参照)の有無に関わらず、投与開始から24週間(6カ月)の時点でもチェックする。
(2) 治療前に1回施行し、CMV DNAが検出された場合は治療開始後2週間の時点でもう1回、その段階でもCMV DNAが検出されたら治療終了後2週間の時点でもう1回チェックする。できればCMV DNAの検出の有無に関わらず、そして治療の継続の有無に関わらず投与開始から24週間(6カ月)の時点でもチェックする。
注6)血液採取にあたってヘパリンが混入するとPCRが阻害されるので加えてはならない。
注7)髄液の採取は困難な場合も多いが、その機会があれば、ウイルス量の定量に加えて、圧測定、外観観察、細胞数と分画、蛋白定量、糖定量を行う。初回の髄液でCMV DNAが検出されなかった場合には、臨床的に中枢神経系病変の増悪が疑われない限りその後の検査は不要である。
2.ウイルス分離と薬剤感受性試験(または薬剤感受性関連遺伝子配列の解析)
採取時期:治療前。治療の各クール終了後に再燃が見られたらその都度。
検体:尿、血液
3.GCV血中濃度
測定時期:第5治療日(± 1日)に実施。VGCV投与後、30分(15-45分)、90分(1-3時間)、6時間(5-7時間)、11時間(10-12時間)の4回採血(血清または血漿として最低0.2 mL)。困難であれば、90分(1-3時間)(予想Cmax)と11時間(10-12時間)(次回投与の直前;Cmin)の2回。
測定法:液体クロマトグラフィー/タンデムマススペクトロメトリー法。
4.聴力検査
実施時期:治療前、治療開始後 6週間、6カ月、1年、2年の 5回実施。困難であれば、治療前と治療開始後 6カ月の2回実施。
測定法:聴性脳幹反応(ABR)
5.眼底検査
実施時期:治療前と治療開始後 6カ月の 2回。ただし治療前に異常が認められた場合には、適宜フォローする。
6.発達評価
評価時期・方法:通常の乳幼児検診の key months(修正4カ月、7カ月、10カ月、18カ月、3歳半など)に遠城寺式(18か月頃まで)または新版K式発達検査(2歳以降)を行い、DQを算定する。
7.脳画像評価
評価時期:治療前と治療開始後 6カ月の 2回。18カ月〜2歳頃にも追跡調査を行うことを推奨する。
評価法:MRI(FLAIRや拡散強調画像も含む)を原則とする。ただし鎮静等の問題でどうしても実施困難な場合はCTを施行する。
8. 副作用チェック
最低測定項目:CBC/diff, ALT, 総ビリルビン、尿酸、クレアチニン
測定時期:治療前に1回、その後治療中と治療終了後最低 2週間までの間は週1回チェック。
注8)grade 2以上の副反応が出現したら、原則投与中止とする。
注9)好中球減少に関しては、500/µL未満になったらいったん中止して >750/µLになるまで待ってfull doseで再開する。再び 好中球数が500/µL未満となったら、50% doseにして >500/µLとなるのを待つ。この用量で好中球数の上昇が認められなければ投与中止とする1)。
追加治療プロトコール
【対 象】
症候性先天性CMV感染に対する初回治療を行った児で、(1)治療終了後に臨床的再増悪がみられた場合、(2)治療終了時点でなお血液中から1 x 104 copies/ml以上のウイルスDNAを検出、または髄液から検出限界以上のウイルスDNAを検出した場合、または(3)治療終了後2週間までにリバウンドして血液中から1 x 104 copies/ml以上のウイルスDNAを検出、または髄液から検出限界以上のウイルスDNAを検出した場合 に考慮する。
【治療方法】
VGCV 経口投与(授乳後) 16 mg/kg/回 x 2回/日 x 6週間
注1)一回目の追加療法の後でも上記(1)〜(3)のいずれかに該当する場合は、同様の追加療法を繰り返し最長 24週間(6カ月)まで延長することを検討する。
注2)追加療法の有効性や安全性は不明であるため、主治医が総合的に適応の判断を下し、保護者へ十分に説明し同意を得られた場合にのみ実施する。例えば単にウイルス学的なリバウンドだけの場合よりも、臨床的なリバウンドが見られた場合には積極的に適応を考える。
【効果判定 および 副作用評価】
初回治療プロトコールを参照のこと。
CMVは基本的に感染成立後終生にわたって体内に持続し、GCVやVGCVはウイルスの増殖を抑制することはできても、ウイルスを根絶することはできない。最近、網膜脈絡膜炎を合併した先天性CMV感染児において、6週間のGCVの終了後に再燃し、最終的に6カ月に及ぶ治療によってコントロールできた事例も報告されており、最適の治療期間は定まっていないしおそらく症例毎に異なる可能性がある。従って、追加治療プロトコールは症例毎に適応の是非を検討すべきものである。
担当
国立感染症研究所 ウイルス第1部・第4室 井上直樹
長崎大学大学院医歯薬学総合研究科 感染病態制御学分野 森内浩幸
症候性先天性CMV感染に対する初回治療を行った児で、(1)治療終了後に臨床的再増悪がみられた場合、(2)治療終了時点でなお血液中から1 x 104 copies/ml以上のウイルスDNAを検出、または髄液から検出限界以上のウイルスDNAを検出した場合、または(3)治療終了後2週間までにリバウンドして血液中から1 x 104 copies/ml以上のウイルスDNAを検出、または髄液から検出限界以上のウイルスDNAを検出した場合 に考慮する。
【治療方法】
VGCV 経口投与(授乳後) 16 mg/kg/回 x 2回/日 x 6週間
注1)一回目の追加療法の後でも上記(1)〜(3)のいずれかに該当する場合は、同様の追加療法を繰り返し最長 24週間(6カ月)まで延長することを検討する。
注2)追加療法の有効性や安全性は不明であるため、主治医が総合的に適応の判断を下し、保護者へ十分に説明し同意を得られた場合にのみ実施する。例えば単にウイルス学的なリバウンドだけの場合よりも、臨床的なリバウンドが見られた場合には積極的に適応を考える。
【効果判定 および 副作用評価】
初回治療プロトコールを参照のこと。
CMVは基本的に感染成立後終生にわたって体内に持続し、GCVやVGCVはウイルスの増殖を抑制することはできても、ウイルスを根絶することはできない。最近、網膜脈絡膜炎を合併した先天性CMV感染児において、6週間のGCVの終了後に再燃し、最終的に6カ月に及ぶ治療によってコントロールできた事例も報告されており、最適の治療期間は定まっていないしおそらく症例毎に異なる可能性がある。従って、追加治療プロトコールは症例毎に適応の是非を検討すべきものである。
担当
国立感染症研究所 ウイルス第1部・第4室 井上直樹
長崎大学大学院医歯薬学総合研究科 感染病態制御学分野 森内浩幸









