はじめに “神経疾患をみる、なおす”
神戸大学脳神経内科では神経疾患の診断学と治療学の2本柱で研究活動を行っています。脳神経内科は、難治性神経疾患の病態解明や高次脳機能を司る神経細胞ネットワークの恒常性理解といった臨床神経科学の最先端を担う研究科の側面を持ちます。
目の前の患者さん一人一人から学び、そこから新たな病態解明や治療法開発につながる未来を目指しています。脳神経内科が診療する神経疾患にはまだ明らかになっていない未知の生命現象が多く含まれます。発展する量子化学計算やAIを活用し、研究の規模を広げると同時に、創造に繋がる人のアイデアを大切に、患者さんの治療薬、ケアに繋がる研究を行なっています。
免疫性神経疾患
【担当 千原、古東、赤谷、辻、刀坂】
神経疾患の多様性の一方で、免疫性神経疾患から神経変性疾患、脳梗塞に到るまで、神経炎症と免疫の関わりが次々明らかになっています。私たちは神経疾患と免疫応答・炎症反応の関わりの解明を目指しています。
過剰な免疫応答は自己免疫疾患の原因となり、極端な免疫抑制はがんや慢性感染症の誘因となります。超高齢社会を迎え、神経変性疾患の病態研究は喫緊の課題ですが、加齢による免疫力低下と神経疾患の関連には一定の見解がありません。我々のグループでは免疫恒常性の維持が健康的な老化に必要であるという仮説に基づいて、神経炎症や神経変性過程における全身性の免疫応答の特徴を解析し、治療介入可能な表面受容体やサイトカインシグナルを同定し、その制御機構を明らかにすることを目的としています。
具体的には、多発性硬化症、視神経脊髄炎、自己免疫性脳炎、認知症患者等の末梢血や髄液検体を用いてフローサイトメトリーによるリンパ球フェノタイプ解析やRNA-seqなどでの網羅的な遺伝子発現解析から、神経細胞と免疫細胞の相互作用に関わる鍵となるシグナル伝達経路とその制御転写機構を明らかにし、病態に即した新規治療薬の開発に取り組んでいます。
また、動物モデルや神経-グリア共培養系等を用いたin vivo/in vitro解析を通じて、免疫細胞とグリア細胞、神経細胞がどのように多細胞間の相互作用を維持し、またその破綻が病気に繋がるのかというメカニズムの解析も行なっています。学内、学外問わず基礎医学分野・臨床医学分野における共同研究も積極的に行っております。また、学生教育の一環として1ヶ月に一度程度、基礎科学のトップジャーナルに発刊された神経と免疫に関わる論文の抄読会を行なっています。ご興味をお持ちの方はお気軽にご連絡ください。
Neuroimmunological Diseases (Norio Chihara, Professor and Chair)
Multiple sclerosis (MS) and Neuromyelitis optica (NMO) are rare intractable neurological diseases that present in clinically diverse ways. Since disease onset can occur at a young age, neurological disability can develop during middle age, increasing the social burden on the lives of patients and their families, as well as producing significant medical expenses. An imbalance between autoimmunity and immune tolerance is thought to be key in pathogenesis. We utilize a systems biology approach to understand co-inhibitory molecular circuits in MS and NMO, as well as to discover novel targets of co-inhibitory receptors (co-iRs) to induce immune tolerization. We are further analyzing sorted subpopulations of T-cells and B-cells by global gene expression analysis and construct the molecular network for co-iRs regulation. Our aim it to uncover the molecular network underlying dysfunctional immune tolerance in MS and NMO. Newly identified co-inhibitory molecules can serve as a complementary treatment target to current treatments, allowing the realization of precision medicine to reduce the burden on patients’ lives and their medical costs. Furthermore, this platform will also be applicable to other refractory immune-mediated neurological diseases, such as autoimmune encephalitis and dementia.
主要業績
- Akatani R, Chihara N, et al. Interleukin-6 Signaling Blockade Induces Regulatory Plasmablasts in Neuromyelitis Optica Spectrum Disorder. Neurol Neuroimmunol Neuroinflamm. 2024 Jul;11(4):e200266. doi: 10.1212/NXI.0000000000200266.
- Koto S, Chihara N, Akatani R, et al. Transcription Factor c-Maf Promotes Immunoregulation of Programmed Cell Death 1-Expressed CD8+ T Cells in Multiple Sclerosis. Neurol Neuroimmunol Neuroinflamm. 2022 Apr 5;9(4):e1166. doi: 10.1212/NXI.0000000000001166.
- Chihara N, Madi A, Kondo T, et al. Induction and Transcriptional Regulation of the Co-Inhibitory Gene Module in T Cells. Nature 558: 454-459, 2018
- Chihara N, Aranami T, Sato W, et al. Interleukin 6 Signaling Promotes Anti-Aquaporin 4 Autoantibody Production From Plasmablasts in Neuromyelitis Optica. Proc Natl Acad Sci U S A 108(9): 3701-3706,2011
てんかん・脳生理
【担当 尾谷、的場、十河】
てんかん・脳生理グループでは
- システム脳科学を応用した高次脳機能とてんかん病態のシステム的解明
- 高齢発症てんかんの学際的な病態研究
を推進しています。
言語・運動・思考といった脳の高次の営みは、大脳の各領域がネットワークを形成しシステムとして機能することで遂行されます。代表的神経疾患の1つであるてんかんでは、大脳皮質の神経細胞が過剰興奮する性質を獲得し、脳機能ネットワークを通しててんかん発作の症状が出現します。すなわち、てんかん病態は正常脳機能と表裏一体で、病態解明には脳のシステム的理解が欠かせません。
私達は非侵襲的な神経画像や脳波を用いた脳表からの直接の神経活動計測に、ネットワーク解析や脳情報解読といった最新のシステム神経科学的解析手法を取り入れ、高次脳機能とてんかん病態のシステム的解明、および病態下の脳機能の可塑性研究を推進しています。ヒトを対象とした臨床システム神経科学研究の推進には学際的な研究が重要であり、本学・国内外の施設と積極的に共同研究を展開しています。
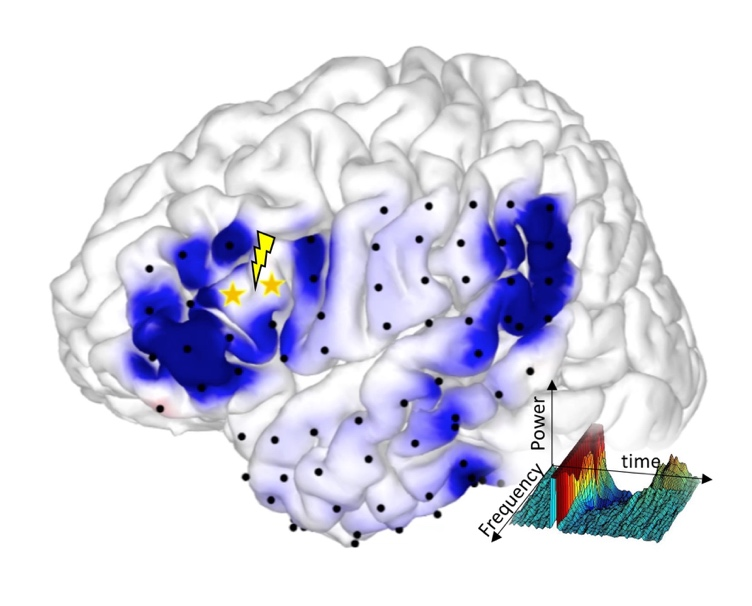
皮質皮質間誘発電位(cortico-cortical evoked potential)による言語ネットワークの可視化

皮質皮質間誘発電位(cortico-cortical evoked potential)による言語ネットワークの可視化
超高齢社会となった日本では高齢発症てんかんが増えてきています。中高年になり神経細胞が過剰興奮をきたす背景病態として、軽度認知障害から病初期のアルツハイマー病態やくすぶり型の自己免疫介在性脳炎が注目されています。
てんかん性放電を神経過剰興奮の生理マーカーとして位置づけ、神経免疫・認知症グループと連携し、電気生理学に免疫・画像・認知神経科学の手法を組み合わせ、ベンチからコホート研究まで幅広く、高齢者てんかんと背景疾患の病態解明、そしてバイオマーカーや治療法の開発に取り組んでまいります。同時に、生理マーカーして脳活動を長時間計測するためには、簡易に装着できるウェアラブル脳波デバイスの開発が重要であり、医工連携でデバイス開発も推進しています。
主要業績
- Masaya Togo, Riki Matsumoto, et al. Role of the premotor and the precentral negative motor area in praxis: A direct electrical stimulation study with behavioral analysis.Clinical Neurophysiolog 2025. https://doi.org/10.1016/j.clinph.2025.03.008
- Matoba K, Matsumoto R, et al. Basal temporal language area revisited in Japanese language with a language function density map. Cereb Cortex 2024. https://doi.org/10.1093/cercor/bhae218
- Togo M, Matsumoto R, et al. Distinct connectivity patterns in human medial parietal cortices: Evidence from standardized connectivity map using cortico-cortical evoked potential. Neuroimage 2022. https://doi.org/10.1016/j.neuroimage.2022.119639
- Togo M, Hitomi T, et al. Short "Infraslow" Activity (SISA) With Burst Suppression in Acute Anoxic Encephalopathy: A Rare, Specific Ominous Sign With Acute Posthypoxic Myoclonus or Acute Symptomatic Seizures. Clin Neurophysiol 2018. DOI: 10.1097/WNP.0000000000000507
認知症
【担当 古和、関,森本】
認知症は認知機能の低下により、日常生活に支障を来たしている状態です。超高齢社会を迎えた本邦では認知症の患者数が500万人に迫る勢いで増加しており、認知症を取り巻く社会情勢が大きく変化してきています。2023年12月には抗アミロイドβ抗体薬であるレカネマブが本邦で導入となり、2024年11月にはドナネマブも使用可能となりました。いずれも対象は軽度認知障害~軽度認知症となるため、より早期の診断に,しかも背景病理に関する正しい診断が求められるようになりました。また2024年には「共生社会の実現を推進するための認知症基本法」が施行され、認知症の人との共生社会の実現を推進していくことになりました。
当院の認知症疾患医療センターの運用は、精神科と共に行っております。神戸市では認知症神戸モデルの一環で認知症の診断助成制度に基づく検診が2019年より開始されています.認知症の有無や背景疾患の鑑別に加えて、2024年からは抗アミロイドβ抗体薬の適応可否の検査も助成対象となりました
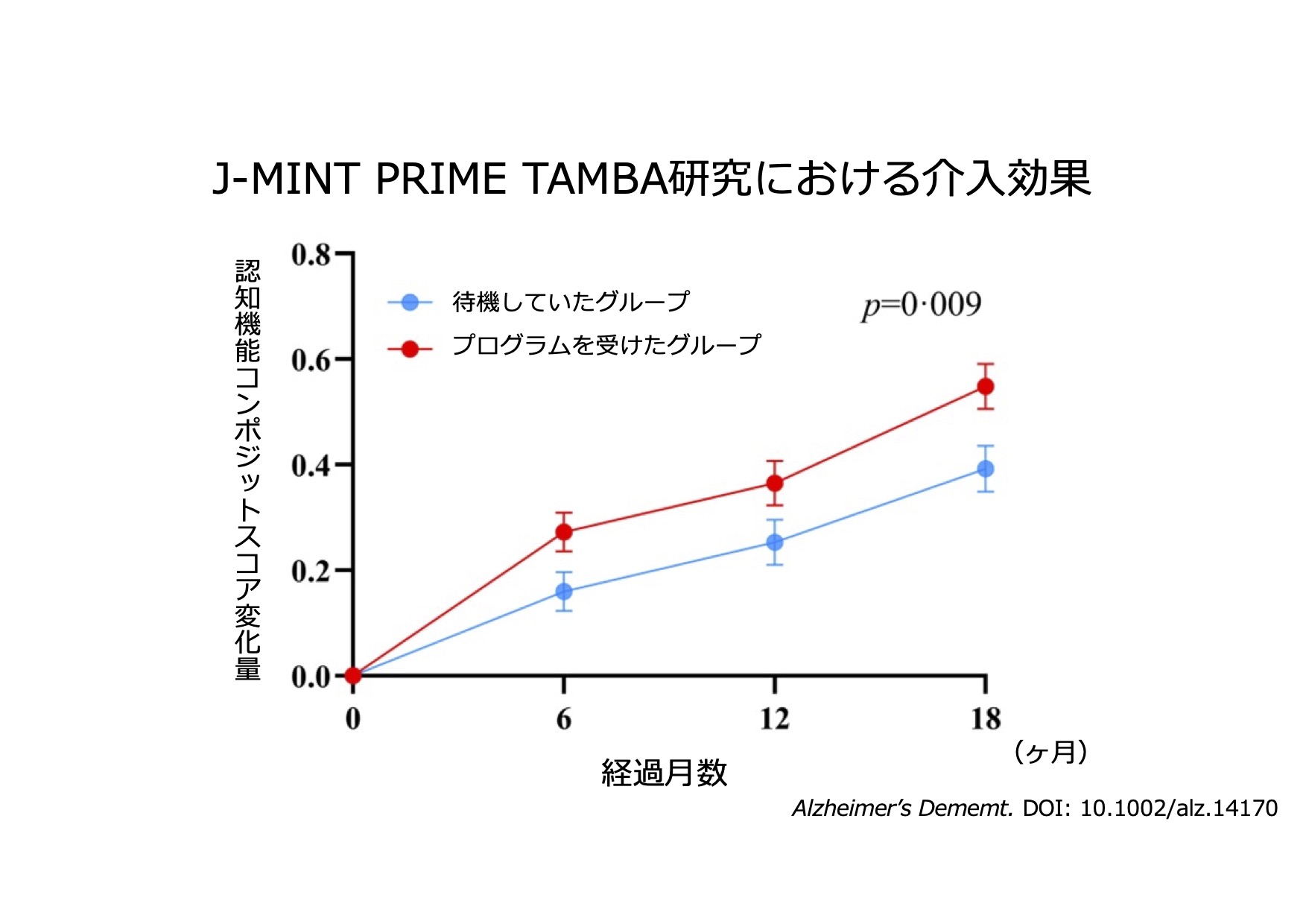
認知症の予防も重用な課題です。丹波市民を対象としたJ-MINT Prime TAMBA研究では、運動、認知機能トレーニング、栄養管理、生活習慣病の管理から成る多因子介入を行うことで高齢者の認知機能が改善することを報告しました。こうした成果の社会実装を実現するために、神戸大学では認知症予防事業“コグニケア”を神戸市はじめ兵庫県内外で展開しています。
臨床研究のテーマとしては,認知症の治療薬開発(治験参加)、血液バイオマーカーやデバイスを用いた早期診断の実現や進行予測因子の探索、認知症とてんかんの連関などがあり、日々の診療に役立てるように精力的に研究を推進しています。
主要業績
- Oki Y, Osaki T, Kowa H, et al. An 18-month multimodal intervention trial for preventing dementia: J-MINT PRIME Tamba. Alzheimers Dement. 2024 ;20(10): 6972-6983.
- コグニケア | 認知症を学び、予防を目指そう
- Tho Chu TQ, Morimoto K, Kowa H. Cognitive performance and blood biomarkers: Insights into their relationship and predicting high Amyloid Probability Score in cognitively impaired older adults. J Alzheimers Dis. 2025; 107(4): 1661-1673.
神経電気診断(electrodiagnosis: EDX)
【担当 関口】
神経や筋肉の病気を正確に診断するには、神経伝導検査・筋電図検査が欠かせません。これらの検査結果を症状や他の検査データと組み合わせて総合的に診療する分野をEDX medicineと呼んでいます。当科ではこのEDX medicineの分野で、最新の検査技術とAI(人工知能)を組み合わせた研究に取り組み、患者さんのより良い治療につなげたいと考えています。
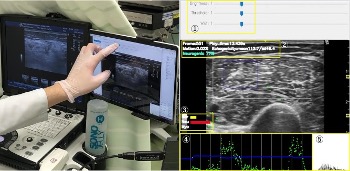
筋電図検査は神経や筋肉の電気的な活動を調べる検査です。私たちはこの筋電図を使って、重症筋無力症や慢性炎症性脱髄性多発神経炎、運動ニューロン病などの難病の進行や重症化を予測するための研究を行っています。
超音波検査は体への負担が少なく、神経領域ではまだ新しい分野ですが、診断への応用が大いに期待されています。超音波で見える筋肉の色合いや質感を数値で表し、病気によって変わる筋肉の特徴を診断に活かす研究を続けています。また、パーキンソン病で起こる”ふるえ”などの不随意運動がどのような仕組みで生じるのかを筋肉の動きという観点から調べる研究も行っており、病気の新たな理解や治療薬の効果を評価する手法としても注目されています。
最近では、超音波検査にAI技術を組み合わせたリアルタイム解析で、神経や筋肉の病気を見分けるソフトウェアも開発しました。このシステムを用いることで、超音波検査をしながらAIがその場で筋肉の状態を判断し、診断の精度向上と検査時間の短縮が期待できます。
こうした研究により、神経筋疾患で困っている患者さんが一日でも早く正しい診断と治療を受けられるよう、私たちは日々努力しています。
主要業績
- Matoba S, Sekiguchi K, et al. “Fascicular twitch” on muscle ultrasonography in neuromuscular disorders: quantitative video-image analysis. Clin Neurophysiol. 2026, 182: 2111447.
- Suehiro H, Sekiguchi K, Noda Y, Matsumoto R. Diaphragmatic compound muscle action potentials correlate with the clinical severity of myasthenia gravis. Muscle Nerve. 2025, 71: 1043-1051.
- Watanabe S, Sekiguchi K, et al. Decreased diaphragm moving distance measured by ultrasound speckle tracking reflects poor prognosis in amyotrophic lateral sclerosis. Clin Neurophysiol Prac. 2024, 9: 252-260.
- Noda Y, Sekiguchi K, Riki Matsumoto R. Real-time artificial intelligence-based texture analysis of muscle ultrasound data for neuromuscular disorder assessment. Clin Neurophysiol Pract. 2024, 19: 242-248.
神経変性疾患
【担当 関谷】
脳神経内科の領域には、いまだ原因が不明で根本的な治療法のない疾患が数多く存在します。その代表がパーキンソン病、脊髄小脳変性症、筋萎縮性側索硬化症などの神経変性疾患です。一旦発症すると日常生活に支障を来し、患者さんやご家族に大きな負担をもたらします。
治療法開発のためには病態理解が必須です。私たちは患者さん・ご家族の同意をもとにいただいた剖検脳を用いて、実際に脳内でどのような変化が生じているのかを研究しています。パーキンソン病やレビー小体型認知症、多系統萎縮症といった疾患では、αシヌクレインというタンパク質が異常凝集して脳内の神経細胞やグリア細胞に蓄積することが知られており、αシヌクレイノパチーと呼ばれます。われわれは、このαシヌクレインの早期凝集体であるαシヌクレインオリゴマーに着目し、詳細な脳内分布や臨床相関の解明に取り組んでいます。
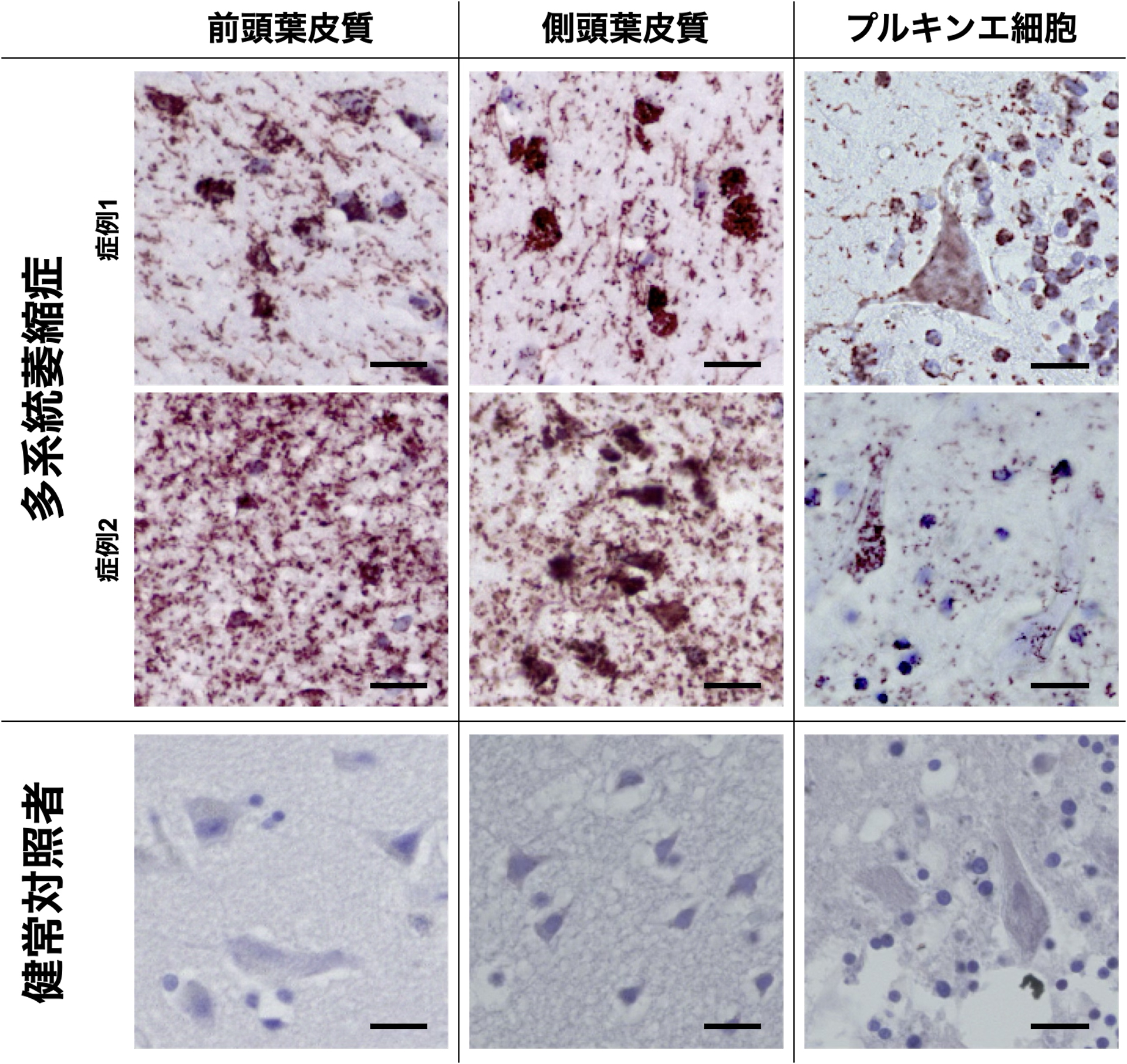
具体的には、近接ライゲーションアッセイ法(PLA法)を応用したαシヌクレインオリゴマー可視化技術を用いて、病理学的解析を行っています。これまでに、多系統萎縮症やパーキンソン病において脳内に広くαシヌクレインオリゴマーが分布していること、レビー小体型認知症の認知機能低下ペースや幻視に特定の脳領域のαシヌクレインオリゴマー蓄積が相関していることを明らかにしてきました。さらに、国内外のブレインバンクや研究施設と協力して、LRRK2変異のような遺伝性パーキンソン病 についても研究を進めており、LRRK2変異パーキンソン病では、レビー小体の有無にかかわらず、全例でαシヌクレインオリゴマーが蓄積していることを明らかにしました。これらの結果は、αシヌクレインオリゴマーが病態機序に重要な役割を果たしていることを示唆しています。加えて、剖検脳で病理診断が確定した症例を用いて、 臨床経過や臨床的特徴についての研究も実施しており、多系統萎縮症の国際診断基準の妥当性検証や、高齢発症の多系統萎縮症の臨床的特徴の検討、多系統萎縮症の臨床診断精度の評価などを行ってきました。
また、機械学習アルゴリズムを神経病理学や神経画像解析に応用した研究も進めてい ます。深層学習を用いた病理組織画像の自動診断システムの開発や、教師なし機械学習を用いた脳MRI画像データの解析により、疾患の新たなサブタイプの同定に成功し ています。例えば、多系統萎縮症において、神経細胞脱落パターンに基づく3つの異なるサブタイプを同定し、早期から線条体黒質系とオリーブ橋小脳系の両者に神経細胞脱落を来す新規サブタイプが急速進行と予後不良を示すことを明らかにしました。これらの機械学習の応用により、神経変性疾患のより正確な分類と新たな病態サブタイプの発見に貢献しています。
さらに、αシヌクレイン特異的発現マウスモデルを作出し、病理変化が脳内でどのように進展していくのかをin vivoで解析しています。これらの研究を通じて、神経変性 疾患の病態メカニズムを解明し、新たな治療法開発に貢献することを目指していま す。
主要業績
- Sekiya H, Franke L, Ono D, et al. Association between visual hallucinations and α-synuclein oligomers in patients with dementia with Lewy bodies.Alzheimers Dement. 2025;21(11):e70904. doi:10.1002/alz.70904
- Sekiya H, Franke L, Hashimoto Y, et al. Widespread distribution of α-synuclein oligomers in LRRK2-related Parkinson's disease. Acta Neuropathol. 2025;149(1):42.Doi:10.1007/s00401-025-02872-9
- Sekiya H, Koga S, Murakami A, et al. Validation Study of the MDS Criteria for the Diagnosis of Multiple System Atrophy in the Mayo Clinic Brain Bank. Neurology. 2023;101(24):e2460-e2471. Doi:10.1212/WNL.0000000000207905
- Sekiya H, Kowa H, Koga H, et al. Wide distribution of alpha-synuclein oligomers in multiple system atrophy brain detected by proximity ligation. Acta Neuropathol. 2019;137(3):455-466. Doi:10.1007/s00401-019-01961-w
