画像ギャラリー / 研究
画像をクリックすると動画または拡大画像をご覧頂けます。|
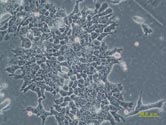
研究室で最も大切な研究材料である遺伝子改変マウスを作製する出発点となるマウス胚性幹細胞(ES細胞)。EB3は、ES細胞の多能性維持に必須であるOct3遺伝子の片アレルにおいて、その遺伝子発現調節領域の下流に薬剤耐性遺伝子を挿入した改変ES細胞である(理研CDB丹羽先生作製)。この細胞で遺伝子ターゲティングを行うことで遺伝子改変マウスの作製が非常に効率的に行えるようになった。 |
|
|
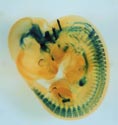
Gfrα1遺伝子座にβLacZ遺伝子を挿入したマウス胎児(E11.5)のX-gal染色像。腸管神経系、腎臓、脳、末梢知覚神経節の一部が染められている。 |
|
|
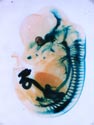
Ret遺伝子座にβLacZ遺伝子を挿入したマウス胎児(E12.5)のX-gal染色像。末梢自律神経節、知覚神経節、脳(主に中脳ドーパミン作動性神経)、腎臓が染められている。 |
|
|
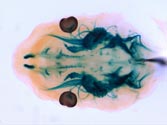
Ret遺伝子座にβLacZ遺伝子を挿入したマウス胎児(E12.5)頭部のX-gal染色像。三叉神経節、頭部副交感神経節(翼口蓋神経節、耳神経節)、脳(主に中脳ドーパミン作動性神経)が染められている。 |
|
|
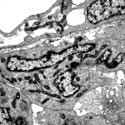
ヒルシュスプルング病モデルマウスの大腸下部における神経前駆細胞の異常。RET遺伝子を欠損させると大腸遠位部のニューロンが細胞死により消失する。この細胞死では、従来のプログラム細胞死(アポトーシス)に起こるクロマチンのコンパクションが認められず、核の異常な分葉が認められた。これは非アポトーシス型の細胞死がヒルシュスプルング病の発症に関わっている可能性を示す一つの根拠となる電顕写真である。 | |
|
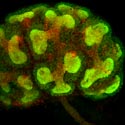
腎臓発生初期における後腎間葉組織に侵入し分岐している尿管芽。尿管芽を形成する細胞膜を赤で染色している。そして遺伝子操作によりGfrα1遺伝子を発現する細胞を緑の蛍光タンパク質で標識している。その結果、Gfrα1が尿管芽の先端部位とその周りの間葉組織に発現している事が容易に確認できた。 |
|
|
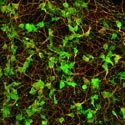
発生過程の腸管壁神経叢は多くのニューロン(赤で染色)が集まっているため個々のニューロンの形態をみることは困難であるが、遺伝子操作により一部のニューロンのみ緑の蛍光タンパク質で標識することで、発生過程における単一のニューロンの突起の形態を捉える事が可能になった。 |
|
|
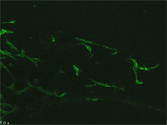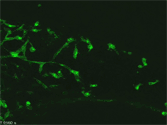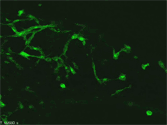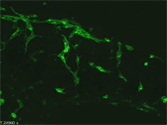
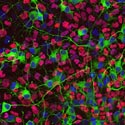
末梢神経節を特殊な培地で培養することにより、そこに含まれる前駆細胞集団を選択的に増やすことができる。写真は、EGFPをノックインしたマウスの副交感神経節より増殖させた前駆細胞を分化させた状態を示す。緑の強い蛍光(RET)を持つ細胞が神経マーカーPGP9.5 (赤)で染めだされている。 |
|
|
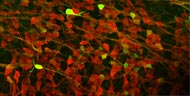
マウスの交感神経節より前駆細胞を選択的に培養・増殖させ、分化させた後、免疫染色した像。緑は神経のマーカーであるTuj1、赤は末梢グリアのマーカーであるSox10、青は自律神経節前駆細胞および神経細胞のマーカーであるPhox2bを示す。 |
|
|
発生期腸管を転写因子Phox2bに対する抗体と、神経細胞のマーカーであるPGP9.5抗体でホールマウント染色し、共焦点顕微鏡で観察した。発生期腸管においては、Phox2bは未分化な腸管神経堤細胞と、分化した神経細胞の両方に発現する事が知られている。図のようにPGP9.5陽性の神経細胞(緑)の核にPhox2bのシグナル(白)が認められる一方、PGP9.5陰性細胞の核にもPhox2bは存在していた(紫)。これはまだ分化していない腸管神経堤細胞の存在を示している。 |
|
|
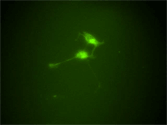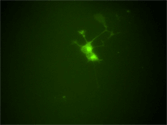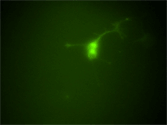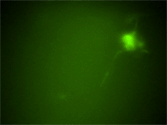
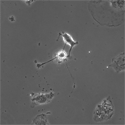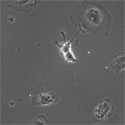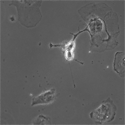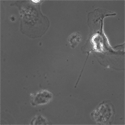
RETのスプライシングアイソフォームであるRet51にEGFPを融合させたキメラタンパク質をRetプロモーター下で発現する、Ret51-EGFPマウスを作成した。このマウスから得られた神経細胞をタイムラプス観察することでRet受容体の局在のダイナミックな変化をとらえることが出来た。RET51-EGFPマウスは、神経突起伸長におけるRETタンパク質の輸送の役割を調べる重要なツールとなっている。 |
|
|
上記動画を同じタイムポイントで位相差顕微鏡下で撮影した。細胞が移動し、突起を伸ばす様子が確認できた。また一部の突起が画面右上から来る間充織系の細胞へ誘引されるように伸びていく様子も観察された。 |
|
|
胎生12.5日目のRet51-EGFPマウス胚から腸管摘出して器官培養し、共焦点顕微鏡下でタイムラプス観察を行った。上の動画同様、この動画におけるEGFP蛍光の挙動はRETタンパク質の挙動そのものを意味している。その結果、移動性の腸管神経堤細胞においてEGFP蛍光が細胞内で極性化された分布を示すことが明らかになった。特に細胞体内において、移動方向に対し核よりも前側に蛍光が集積する様子が観察された。細胞内におけるRETタンパク質の極性化した分布が、腸管神経堤細胞の細胞移動に重要であるという事が示唆される。 | |





_PGP9(G)_t.jpg)