臨床研究
頭蓋内出血を合併した急性期感染性心内膜炎に対する早期手術の工夫
急性期感染性心内膜炎(IE)に対する心臓手術の至適時期について、特に頭蓋内出血をきたした症例においては、人工心肺(CPB)中の抗凝固によるさらなる出血の増悪をきたすリスクもあり、許される状況であれば、4週間の待機が推奨されているのが現状です。ただ、塞栓イベントの再発や進行する心不全、制御困難な感染など、状態によっては早期手術が望ましい症例に時折遭遇します。
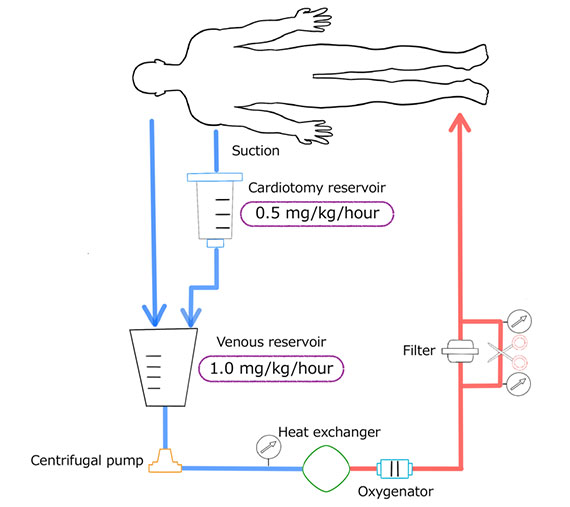
そこで我々神戸大学では、2005年から人工心肺中の抗凝固として低用量ヘパリンとナファモスタットメシル酸塩を併用することで、それらリスクの高い症例への早期手術を行ってきました(画像1)。
2005年から2023年までの間に、頭蓋内出血を伴った急性期IEに対して、可動性のある疣腫または臓器塞栓イベントの存在のため、診断から2日間(中央値)で早期開心術を行っており、それらに頭蓋内出血の増悪はみられませんでした。1例のみ新たな異所性微小出血を指摘されましたが、神経学的所見の悪化はみられませんでした。術前は微小出血がほとんどの割合を占めますが、中には(画像2)のように大きな出血巣のある患者にもこの戦略で早期手術を行った事例もあり、その方も同様に出血や神経学的異常の増悪はありませんでした。
ナファモスタットメシル酸塩を用いた我々の戦略により、頭蓋内出血を伴う患者に対しても出血の増悪を伴うことなく、安全に早期手術を行うことが可能であることが示されました。
Hasegawa S, Takahashi H, Yamanaka K, Okada K. New strategy of early surgery for infective endocarditis complicated by intracranial hemorrhage. Surg Today 2024. Published online: 27 November 2024. https://doi.org/10.1007/s00595-024-02964-1
CTの画像診断におけるTrue 3Dを用いた心臓の形態学的な術前評価
近年の心臓血管外科領域における画像診断の分野における技術革新は目覚ましく、術前の画像から適切な術式を予測することが可能となってきました。我々のグループでは、心臓CT検査や心臓超音波検査といったモダリティーを活用して臨床研究を行っています。また、画像を用いて工学系分野の研究者と共同で実験を行い、より適切な治療に結びつくように日常診療へフィードバックするよう研究をすすめております。
2020年より、CT画像を専用のworkstationとモニターを使用することで3Dホログラムに表示する機器(True 3D)を導入し、大動脈基部に対する術前評価目的で臨床研究を始めています。これまでの一般的なworkstationと違い、撮影されたCTから3Dの画像を空間上に表示できるのでより術中に近い術前評価が可能となっています。これによって手術の際に用いる人工血管のサイズや用いる手技について術前から予測することが可能となっております。
Tsujimoto T, Tedoriya T, Yamauchi Y, Okita Y, Okada K. Virtual Reality Computed Tomography Evaluation - Anatomy and Clinical Implications for Valve-Sparing Aortic Root Replacement. Circ J. 2022 Oct 8. doi: 10.1253/circj.CJ-22-0334. Online ahead of print.PMID: 36216551
情報公開文書:https://drive.google.com/file/d/1Nzxr6RtunMvXYlSDcajEsaeXKP-nuO7b/view?usp=sharing

図:True 3D使用イメージ図
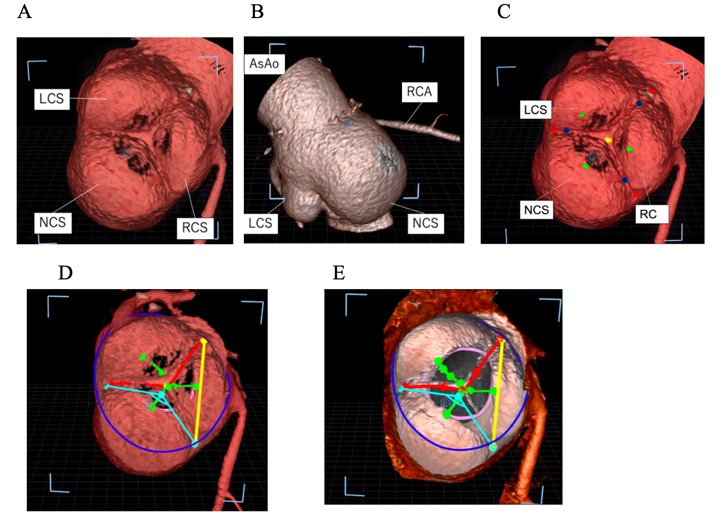
図:実際に計測している画像
深層学習を用いた非造影CTにおける大動脈解離の診断アルゴリズムの構築
急性大動脈解離は突然前触れなく発症する病気であり、発症するとすぐに診断し治療にあたる必要がある怖い病気です。当科ではCTを撮影するとすぐに診断が可能となるために、CTにて撮影すると自動で大動脈解離の診断を補助するアルゴリズムを人工知能の技術を用いて作成するべく研究しております。特に造影剤を使わない非造影CTでの診断を可能にするべく研究をすすめ、現段階でも造影CTと変わらない診断精度があるアルゴリズムを作成できております。
情報公開文書:https://drive.google.com/file/d/1PtVdXLt41Des5bjg7_PQf5DnDlQsXbL2/view?usp=sharing
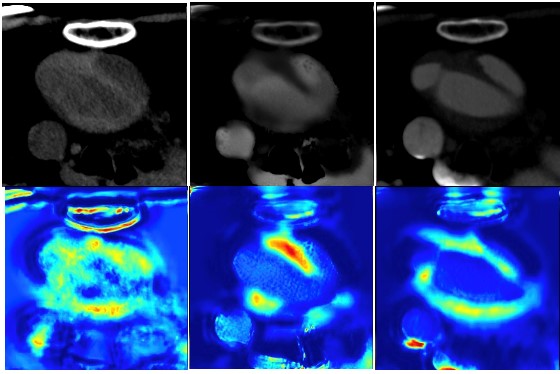
図. 上:CT画像 非造影CT画像(左)、合成CT画像(真ん中)、造影CT画像(右)
下:Grad-CAM画像
大動脈末梢動脈救急治療におけるICTを用いた医療機関連携
お近くの病院に受診または救急で運ばれてから、別の病院で緊急手術を受ける場合、手術までの時間を短くすることでより救命率が向上します。しかしながら、手術前には様々な情報が必要となります。そこで、インターネットを介したスムーズな情報共有技術を駆使することでより緊急手術前の情報共有に要する時間を短縮し、より患者さんの救命率をアップすることができる可能性があります。そこで2021年12月から他病院より紹介となり神戸大学医学部附属病院で緊急手術を受けられた方を対象として、このインターネットを介した情報共有を行っております。それによって、迅速で正確な治療が可能となり患者さんの予後改善につながってきております。
情報公開文書:https://drive.google.com/file/d/1f15Rsbyrir5g0-qiUDsiMaxduin-q08I/view?usp=sharing
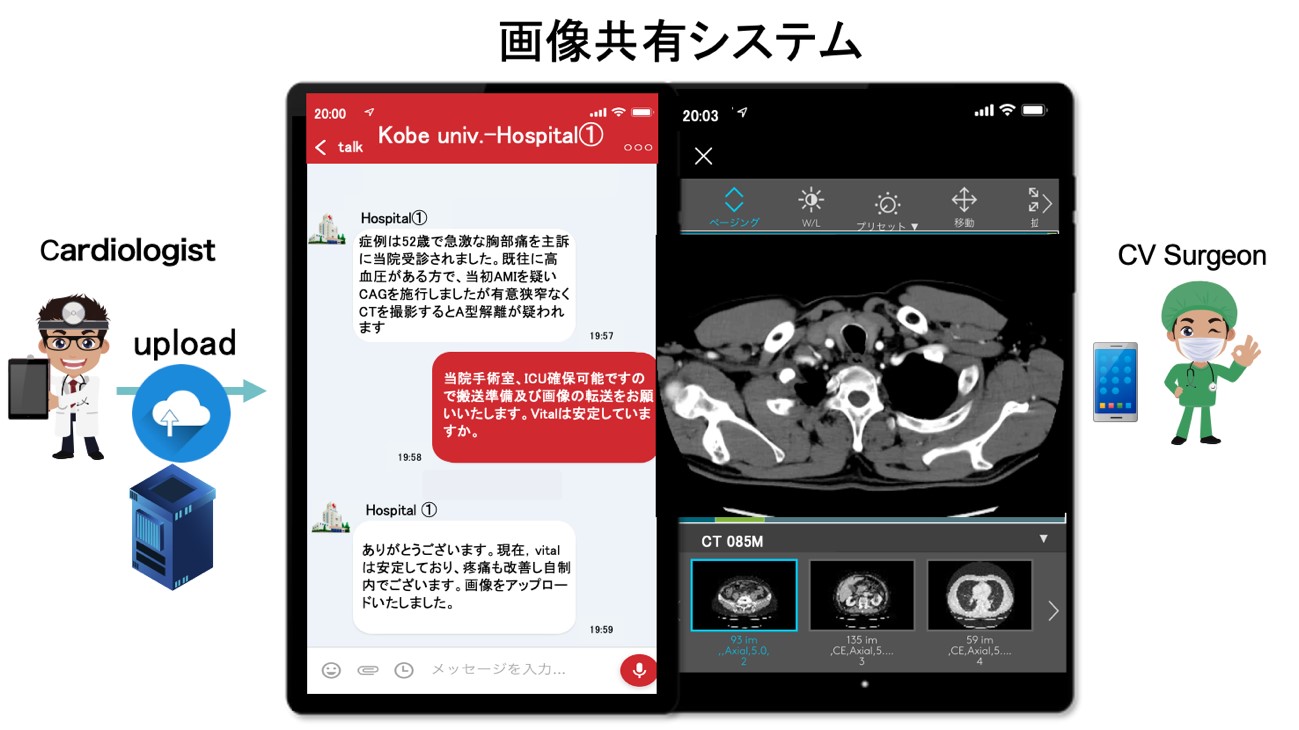
流体工学的解析を取り入れた大動脈弁形成術・右室流出路再建術のin vitro実験
- 背景
先天性心疾患にて正常な肺動脈弁を持たない患者に手作りの弁を縫着する右室流出路再建術 (図1) は, 共に必要に迫られて実臨床で導入され試行錯誤を繰り返すことで発展してきた. しかし, このような過程は倫理的および時間的制約が当然大きい. 対象患者に科学的根拠に基づいた医療を遅延なく提供するため, 本研究では大動脈弁形成後モデルまたは実際の手作り肺動脈弁を循環模擬回路に組み込み, 粒子画像流速測定法 (Particle Image Velocimetry, PIV) を含めた弁機能の流体工学的評価を行うことで, 各テクニックやデザインの優劣を探求する.
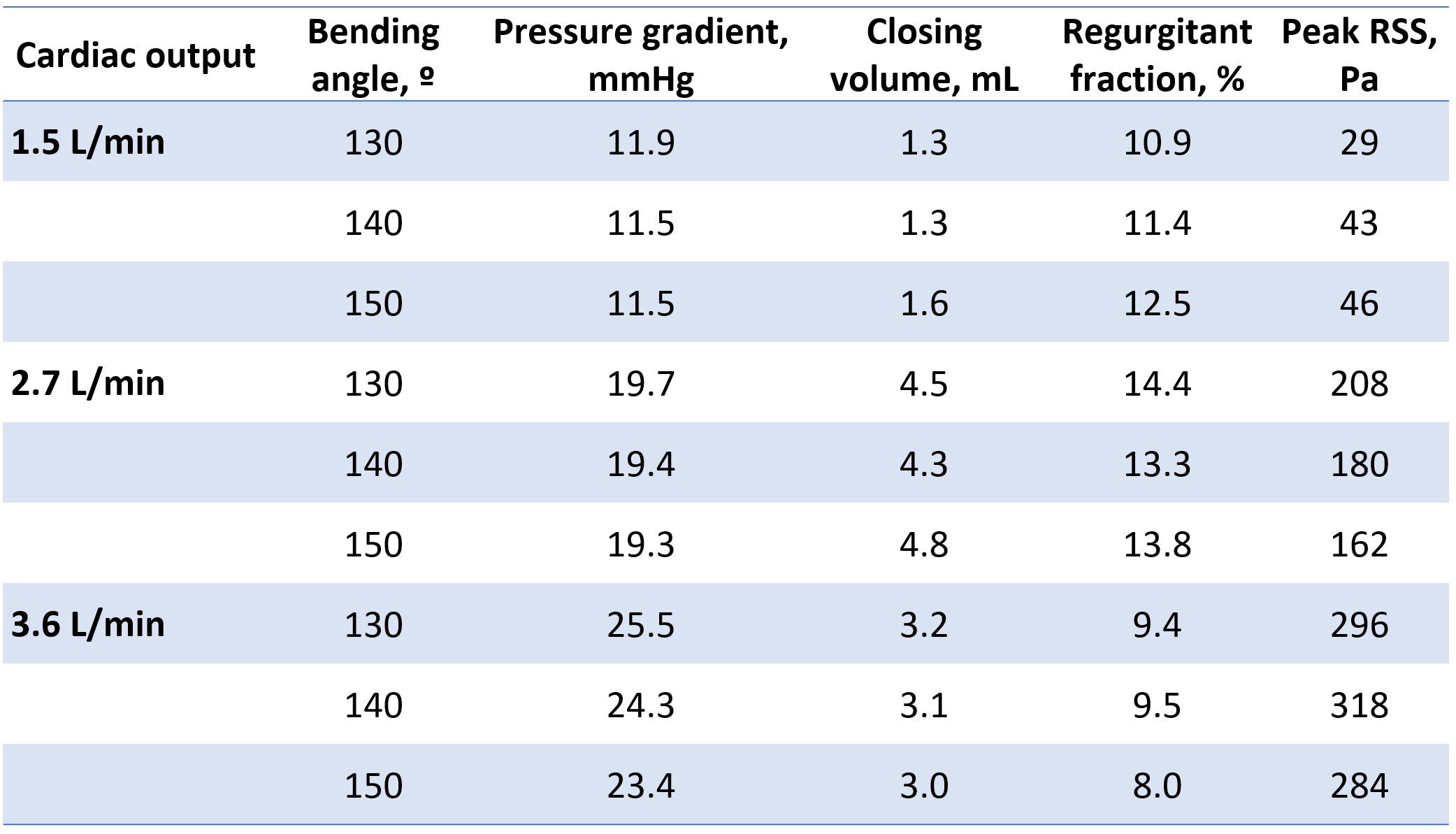
表1. 弁機能評価結果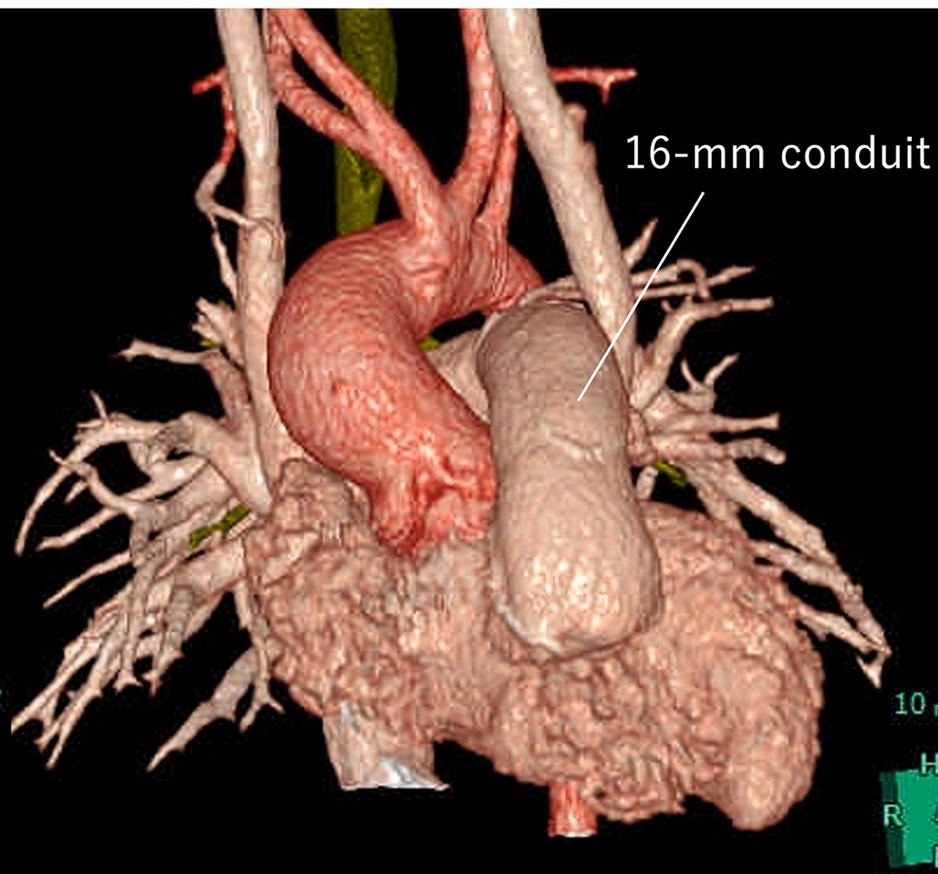
図1. 右室流出路再建術
Matsushima et al, J Thorac Cardiovasc Surg in press.
- 方法
循環模擬回路は拍動型ポンプ・試験部・超音波血流計・コンプライアンスチャンバー・回路抵抗調整バルブ・リザーバータンクから構成される (図2). 試験部に大動脈弁モデルまたは手作り肺動脈弁を接続し, 弁前後差圧や超音波血流計で計測する瞬時流量の測定に加えて, 試験部下流方向から観察窓を設置し弁挙動を高速度カメラにて撮影する. そして2次元3成分ステレオPIVによる流速分布を取得し, 解析により応力・渦度・損失エネルギーを算出する. 実験条件は流量・脈拍数・血圧レベルであり, 実患者のデータをもとにパラメトリックに変化させ, 弁形状やデザインに対する客観的な機能評価を行う.
その後さらに本研究では, 最新の3Dプリンタ (Keyence AGILISTA-3200) を用いて, 弁周辺をゴム素材で, 弁の上流部および下流部を透明素材で作製しつなぎ合わせて試験部とする. 弁外枠・上流部・下流部のデザインは, こちらも実患者から得られたCT画像データからパラメトリックに変化させることで, より患者循環を忠実に再現した環境を構築する.
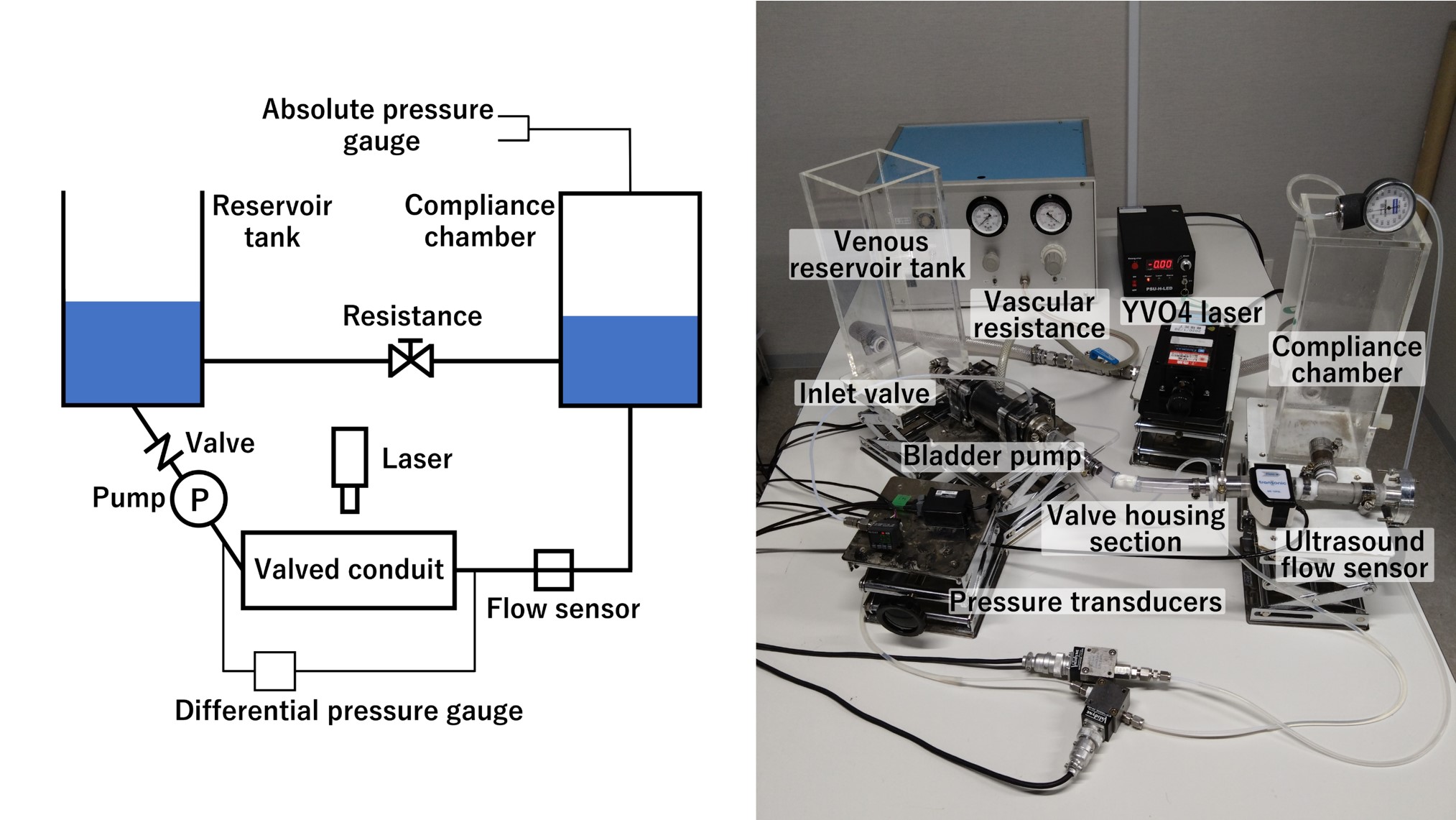
図2. 循環模擬回路
- 進捗
兵庫県立こども病院で使用している16mm径手作り肺動脈弁 (図3) を, 移植で想定されるbending angle (130, 140, 150º) で回路に組み込み, 患者の成長を模した流量 (1.5 L/min, 2.7 L/min, 3.6 L/min) で弁機能評価を行った. 観察窓からの撮影で弁はデザインの意図どおりに挙動していることが確認された (図4). 差圧系と血流計の解析からは表1の結果が得られた. PIV解析では図5の結果が得られ, 血球への流体的影響を測るReynolds shear stressを算出しそのPeak値を弁機能指標として追加した (表1). これら結果は国際学会 (AATS 103rd Annual Meeting) および国際雑誌 (Matsushima et al, J Thorac Cardiovasc Surg in press) にて報告済みである.
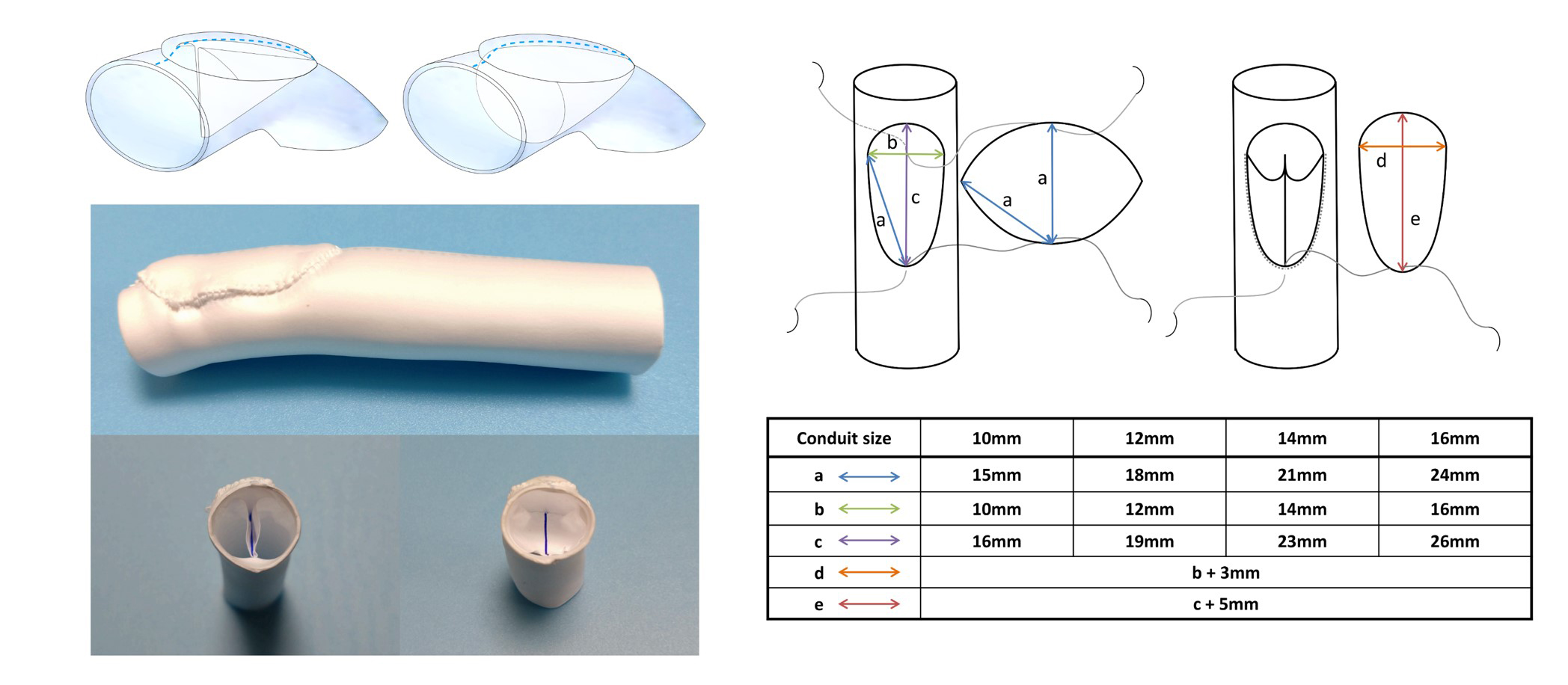
図3. 兵庫県立こども病院で採用している導管デザイン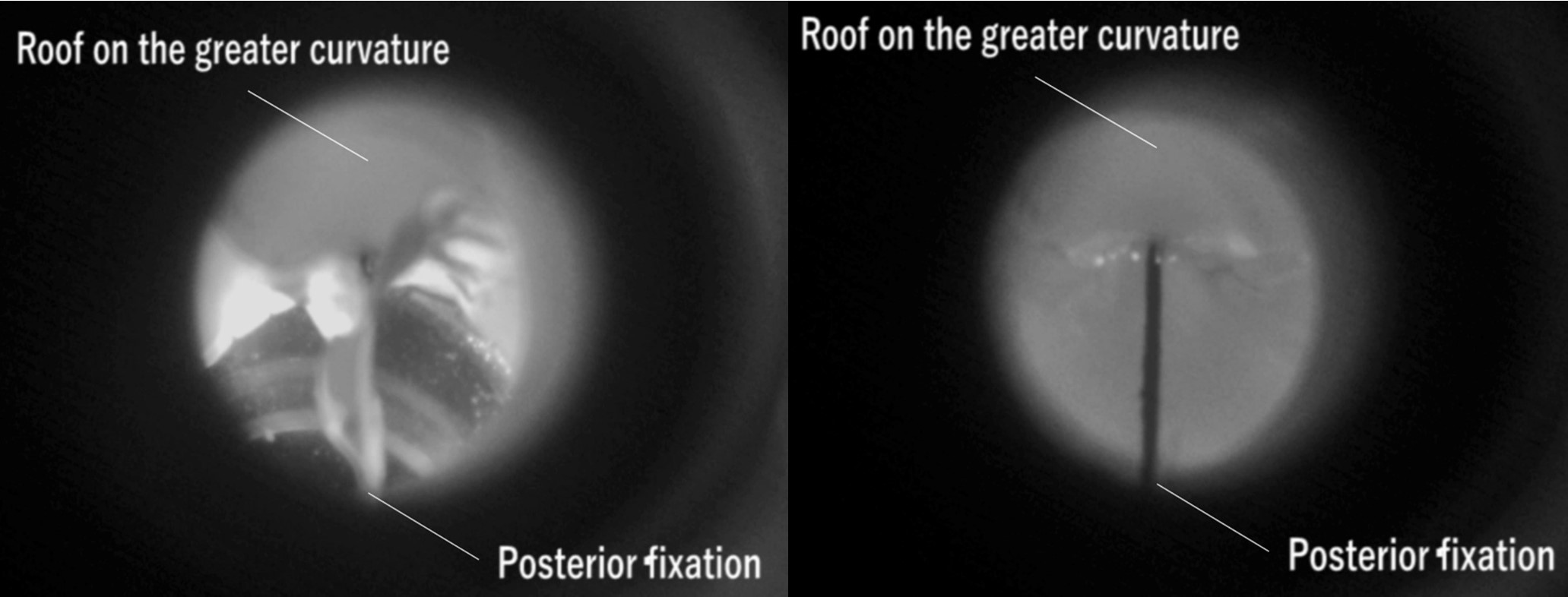
図4. 弁挙動観察画像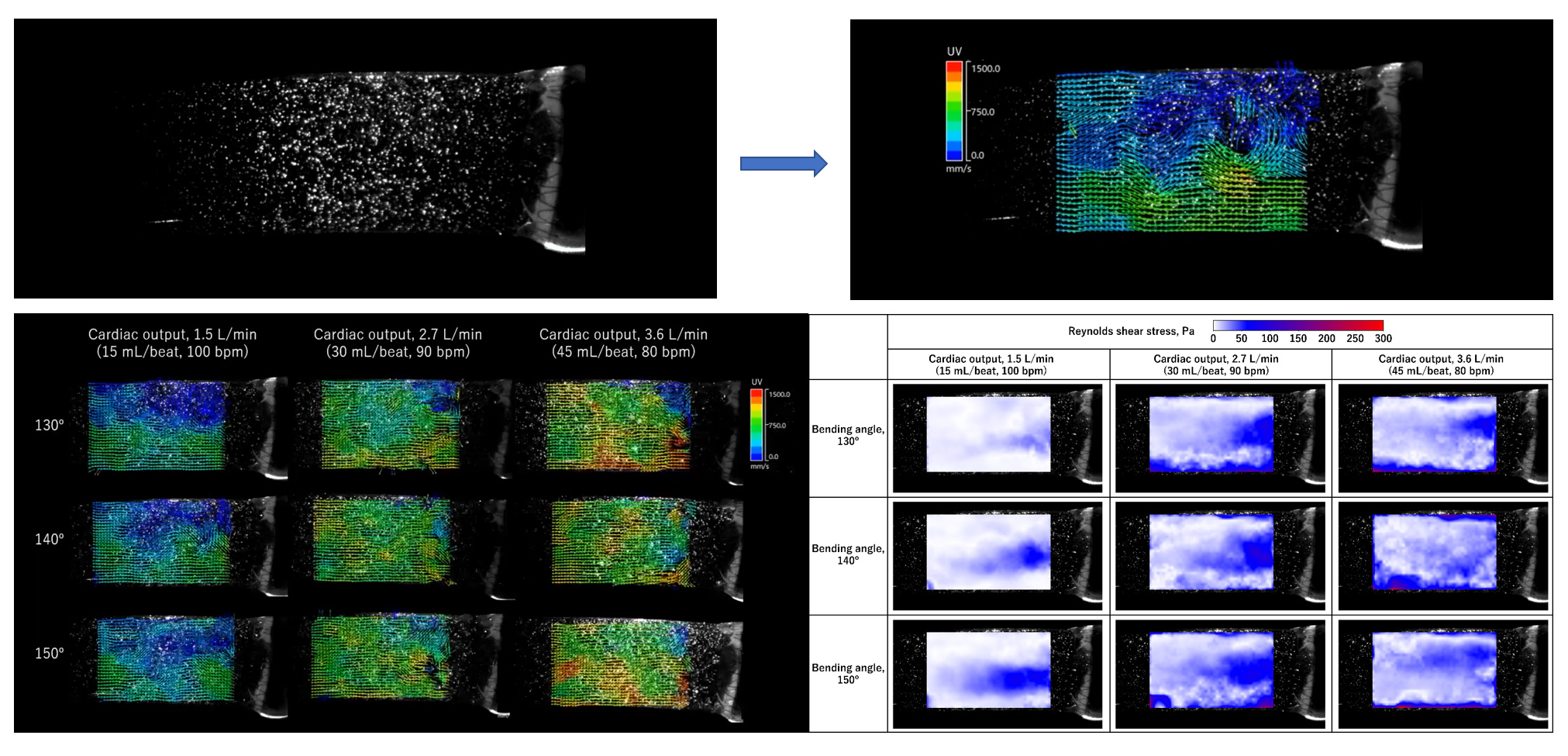
図5. Particle Image Velocimetryとその解析結果
- 研究のゴール
実臨床に即したin vitro実験系と, PIV解析を含めた弁機能評価の新しいGold standardを確立する. それを基にした弁デザイン改良や, さらには患者ごとに弁デザインを調整するオーダーメイド医療の創出を見据える.
自己弁温存大動脈基部置換術
1999年10月以降、当施設では積極的に自己弁温存大動脈基部置換術を施行し約100例に達しております。大動脈基部拡大のみならず弁変形を伴う症例に対しても治療適応が拡大されるようになりその有効性は海外においても報告されています。温存した大動脈弁の耐久性が一番の問題となりますが、耐久性向上のため当施設では早期からバルサルバ洞を有する人工血管の作製や、最近では術中大動脈弁のeffective heightを測定するなどの工夫を行っています。
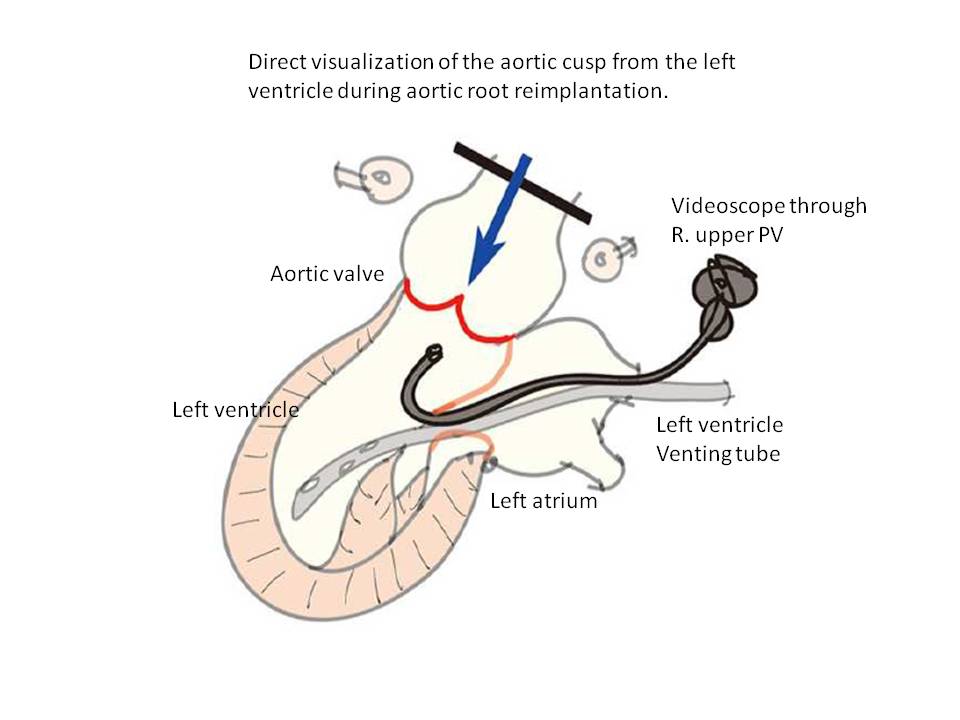
僧帽弁形成術とは異なり、大動脈弁形成術の際に有効な逆流テストが存在しないため従来、自己弁温存大動脈基部置換術、特に大動脈弁形成術を追加するような症例では、心拍動を再開し術中の経食道心エコーで評価を行い、逆流残存すれば再び心停止し形成術を追加していました。視覚的に確認できる逆流テストの確立が待望されていましたが、大北教授のグループは内視鏡を左室内に誘導し、左室側から大動脈弁の逆流の部位、程度を正確に評価し心拍動再開前に逆流評価しうる方法を確立しました。この方法を用いることで自己弁温存大動脈基部置換術の精度は益々向上することが期待できます。
Okita Y, Oka T, Miyahara S, Okada K. Direct visualization of the aortic cusp from the left ventricle during aortic root reimplanation. J Thorac Cardiovasc Surg 2012 Oct;144(4):981-2
少数例ではありますが再手術となる症例もあり、その機序に関してはあまり報告がありません。成績向上のためにはその解析が不可欠であり昨年論文報告しております。
Oka T, Okita Y, Matsumori M, Okada K, Minami H, Munakata H, Inoue T, Tanaka A, Sakamoto T, Omura A, Nomura T.
Aortic regurgitation after valve-sparing aortic root replacement: modes of failure.
Ann Thorac Surg 2011 November;92(5):1639-44.
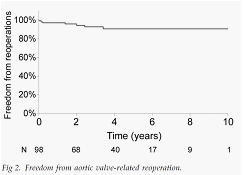
図は良好な大動脈弁関連再手術回避率を示しています。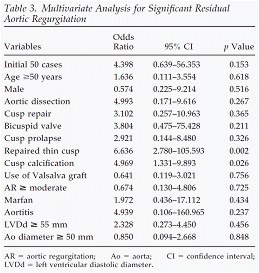
表は大動脈閉鎖不全症残存の危険因子は菲薄化や石灰化した大動脈弁であることを示しています。
Matsumori M, Tanaka H, Kawanishi Y, Onishi T, Nakagiri K, Yamashita T, Okada K, Okita Y. Comparison of distensibility of the aortic root and cusp motion after aortic root replacement with two reimplantation techniques: Valsalva graft versus tube graft. Interact Cardiovasc Thorac Surg 2007 April;6(2):177-81.
Miyahara S, Omura A, Sakamoto T, Nomura Y, Inoue T, Minami H, Okada K, Okita Y.Impact of postoperative cusp configuration on midterm durability after aortic root reimplantation.
J Heart Valve Dis. 2013 Jul;22(4):509-16
大動脈弓部全置換術
大動脈弓部置換術は当施設で盛んに行われている手術のひとつであり、その手術成績は向上してきました。現在までに解離、非解離症例に対し400例以上の手術件数を有し、最近では年間50例程度施行されています。その術式はほぼ標準化され、病院死亡率、脳合併症の頻度も低下しております。しかしながら手術侵襲は大きく術前リスク評価が極めて重要であります。関連の論文を示します。
Okada K, Omura A, Kano H, Sakamoto T, Tanaka A, Inoue T, Okita Y. Recent advancements of total aortic arch replacement. J Thorac Cardiovasc Surg 2012 Jul;144(1):139-45
大動脈性状、術前脳血管障害、併存肺疾患を十分考慮し、人工心肺時のカニューラ選択、順行性選択的脳灌流法、早期復温による手術時間の短縮、Sivelestatの使用、人工心肺中の厳格な水分バランス維持などの工夫により、病院死亡率は急性A型大動脈解離、破裂による緊急手術を含めた場合4.4%、待機手術に限ると1.9%、さらに2006年度以降では1%と極めて良好な成績を示しています。病院死亡の危険因子は80歳以上、急性A型大動脈解離に伴う術前脳障害、人工心肺時間の延長であった。(2006年以降に限れば80歳以上は危険因子ではない)。
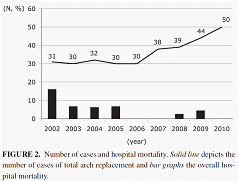
図は当科における手術件数の推移(実線)と病院死亡率(棒グラフ)を示します。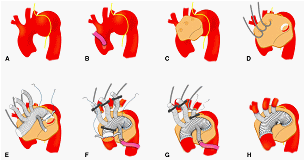
当科での大動脈弓部全置換術のschemaです。当科大村医師が描いてくれました。J Thorac Cardiovasc Surg 2012 Jul;144(1):139-45掲載号の表紙を飾りました。
大動脈弓部全置換術の重篤な合併症に脳梗塞があります。術前、脳MRIで撮影される脳白質虚血性変化がその危険因子であることを報告しています。
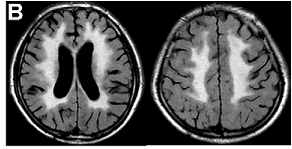
図は高度の脳白質虚血性変化を示しています。
Morimoto N, Okada K, Uotani K, Kanda F, Okita Y. Leukoaraiosis and hippocampal atrophy predict neurologic outcome in patients who undergo total aortic arch replacement. Ann Thorac Surg 2009 August;88(2):476-81.
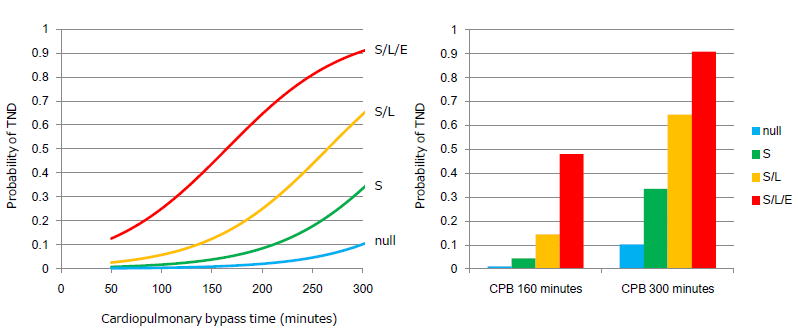
近年、大動脈弓部全置換術時の恒久的脳障害(PND: permanent neurological deficits)の発症頻度は激減しましたが、いまだ覚醒遅延、不穏、一過性神経障害などの一過性脳障害(TND: transient neurological deficits)の発生を認め、これらはPND発症の予備軍であるため注意を要します。我々は、TND発症の危険因子が、上行、弓部大動脈の高度粥腫病変(いわゆるshaggy aorta)、先に述べた中等度以上の脳白質虚血性変化、有意な頭蓋外頚動脈病変、人工心肺時間が有意な危険因子であることを証明し、TND発症の予測式を算出し、logistic curveを描いたところ、それら因子の組み合わせでTND発症が指数関数的に上昇することを示しました。
図で、S: shaggy aorta、L: 脳白質虚血性変化、E: 頭蓋外頚動脈病変、横軸は人工心肺時間を示します。例えば人工心肺時間が160分の場合、TNDの発症率は合併症を有さない場合4%であるものが、shaggy aorta合併すると4.4%、さらに脳白質虚血性変化を合併すると14.4%、さらに頭蓋外頚動脈病変を伴うと48%にも及び注意を要することを示しました。
Okada K, Omura A, Kano H, Inoue T, Oka T, Minami H, Okita Y Effect of atherothrombotic aorta on outcomes of total aortic arch replacement.
J Thorac Cardiovasc Surg 2013 April;145(4):984-991
Shirasaka T, Okada K, Kano H, Matsumori M, Inoue T, Okita Y
New indicator of postoperative delayed wakening after total aortic arch replacement
Eur J Cardiothoracic Surg in press
Okada K, Omura A, Kano H, Nakai H, Miyahara S, Minami H, Okita Y
Outcome of Elective Total Aortic Arch Replacement in Patients with Non-Dialysis Dependent Renal Insufficiency Stratified by Estimated Glomerular Filtration Rate
J Thorac Cardiovasc Surg 2014 Mar;147(3):966-972.e2.
Okita Y, Okada K, Omura A, Kano H, Minami H, Inoue T, Miyahara S
Total arch replacement using antegrade cerebral perfusion
J Thorac Cardiovasc Surg 2013 Mar;145(3 Suppl):S63-71.
Okada K, Omura A, Kano H, Shirasaka T, Yamanaka K, Miyahara S, Sakamoto T, Tanaka A, Inoue T, Oka T, Minami H, Okita Y
Short and Mid-term Outcomes of Elective Total Aortic Arch Replacement Combined with Coronary Artery Bypass Grafting
Ann Thorac Surg 2012 Aug;94(2):530-6. Epub 2012 May 26.
Hino Y, Okada K, Oka T, Inoue T, Tanaka A, Omura A, Kano H, Okita Y
Extended replacement of the thoracic aorta
Eur J Cardiothorac Surg in press
Okada K, Tanaka A, Munakata H, Matsumori M, Morimoto Y, Tanaka Y, Maehara T, Okita Y.
Extended replacement of aortic arch aneurysms through left posterolateral thoracotomy.
Eur J Cardiothorac Surg 2009 February;35(2):270-5.
Morimoto N, Morimoto K, Morimoto Y, Takahashi H, Asano M, Matsumori M, Okada K, Okita Y. Sivelestat attenuates postoperative pulmonary dysfunction after total arch replacement under deep hypothermia. Eur J Cardiothorac Surg 2008 October;34(4):798-804.
Asano M, Okada K, Nakagiri K, Tanaka H, Kawanishi Y, Matsumori M, Munakata H, Okita Y. Total arch replacement for aneurysm of the aortic arch: factors influencing the distal anastomosis. Interact Cardiovasc Thorac Surg 2007 June;6(3):283-7.
急性大動脈解離
急性大動脈解離に伴う脳灌流障害は重篤な合併症でありますが標準的な治療法は未だ確立されていません。
我々は以前より脳障害軽減のための様々な工夫を行って参りました。脳灌流障害の原因には1)頸動脈の解離腔(偽腔)拡大による血流障害に加え、2)偽腔の血栓がリエントリーを介し血栓塞栓症を引き起こす事実を確認しました。
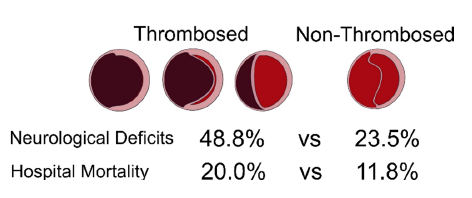
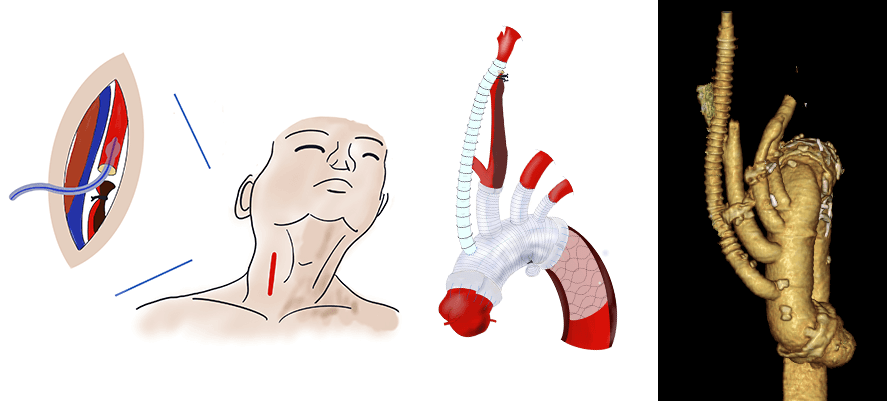
両者を予防するために頸動脈に直接アプローチし早期灌流を行い、同時に偽腔内の血栓を可能な限り摘出し総頚動脈にバイパスする方法を確立しました(図)。本術式が脳梗塞悪化の軽減に貢献していることを論文報告しています。
Inoue T, Omura A, Chomei S, Nakai H, Yamanaka K, Inoue T and Okada K. Early and late outcomes of type A acute aortic dissection with common carotid artery involvement. JTCVS open 2022;10:1-10.
急性大動脈解離は急激に発症する非常に危険な疾患でありますが、近年その手術成績は向上しております。しかしながら解離による臓器灌流不全は障害臓器を生み出しさらなる悲劇をもたらす病態で、特に脳、腸管に発生した場合致命的になります。脳灌流障害の重篤性、早期灌流の必要性を報告してきました。
Morimoto N, Okada K, Okita Y. Lack of neurologic improvement after aortic repair for acute type A aortic dissection complicated by cerebral malperfusion: predictors and association with survival. J Thorac Cardiovasc Surg 2011 December;142(6):1540-4.
Tanaka H, Okada K, Yamashita T, Morimoto Y, Kawanishi Y, Okita Y. Surgical results of acute aortic dissection complicated with cerebral malperfusion. Ann Thorac Surg 2005 July;80(1):72-6.
同時に早期再灌流法を模索、動物実験も施行しその有用性を報告しました。
Munakata H, Okada K, Kano H, Izumi S, Hino Y, Matsumori M, Okita Y. Controlled earlier reperfusion for brain ischemia caused by acute type A aortic dissection. Ann Thorac Surg 2009 April;87(4):e27-e28.
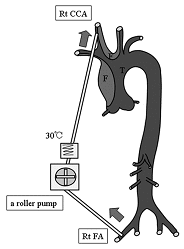
患者さんは72歳の女性で、急性A型大動脈解離に脳灌流障害を合併し発症後3時間で来院されました。来院時は昏睡状態で右総頚動脈血流も低下していました。手術場へ搬送するまでの間に右大腿動脈から右総頚動脈真腔へのシャントを作製し血液を少し冷却し左右の脳酸素飽和度に差がなくなるまで送血しました。
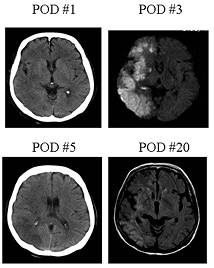
術後3日目の脳MRIでは右半球の大きな梗塞像を認めておりますが、術後必発する高度の脳浮腫は認めておりません。幸い患者さん杖歩行で退院されました。
胸腹部大動脈瘤
胸腹部大動脈瘤の手術件数は140例ほどに及んでいます。手術では人工血管置換術を施行すると同時に多臓器を保護する必要があります。なかでも脊髄虚血は術後QOLを損なう重篤な合併症です。以下の論文で脊髄障害の起こる頻度、その機序、予防のための様々な工夫を膨大な文献を引用しreviewしております。ぜひご一読ください。
Okita Y. Fighting spinal cord complication during surgery for thoracoabdominal aortic disease. Gen Thorac Cardiovasc Surg 2011 February;59(2):79-90.
Munakata H, Okada K, Kano H, Izumi S, Hino Y, Matsumori M, Okita Y. Controlled earlier reperfusion for brain ischemia caused by acute type A aortic dissection. Ann Thorac Surg 2009 April;87(4):e27-e28.
また手技を中心に記載した大北先生の論文が発表されました。きれいな手術図が描かれておりFree Accessです。以下ご覧ください。
脊髄障害をきたす原因のひとつに脊髄への側副血行路の血流低下があります。そのため人工心肺中を含め離脱後、止血中、術後において血圧を十分保つことは極めて重要であることを報告しております。
Kawanishi Y, Okada K, Matsumori M, Tanaka H, Yamashita T, Nakagiri K, Okita Y. Influence of perioperative hemodynamics on spinal cord ischemia in thoracoabdominal aortic repair. Ann Thorac Surg 2007 August;84(2):488-92.
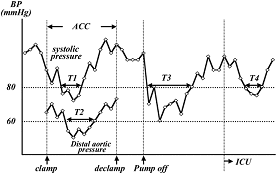
図の胸腹部大動脈瘤手術における血圧の推移示している。 T3は人工心肺離脱後の収縮期圧80mmHg以下であった時間帯を示している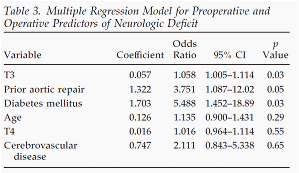
表は術後の脊髄障害の危険因子解析結果を示す。
人工心肺離脱後の低血圧(T3)が危険因子であることを示している。
Kawanishi Y, Munakata H, Matsumori M, Tanaka H, Yamashita T, Nakagiri K, Okada K, Okita Y. Usefulness of transcranial motor evoked potentials during thoracoabdominal aortic surgery. Ann Thorac Surg 2007 February;83(2):456-61.
Omura A, Tanaka A, Miyahara S, Sakamoto T, Nomura Y, Inoue T, Oka T, Minami H, Okada K,Okita Y
Early and late results of graft replacement of dissecting aneurysm of thoracoabdominal aorta in patients with Marfan syndrome
Ann Thorac Surg 2012 Sep;94(3):759-65. Epub 2012 Jul 20.
Omura A, Yamanaka K, Miyahara S, Sakamoto T, Inoue T, Okada K, Okita Y
Early patency rate and fate of reattached intercostal arteries after repair of thoracoabdominal aortic aneurysms
J Thorac Cardiovasc Surg in press
大動脈関連感染疾患
大動脈治療の対象に大動脈関連感染疾患があります.自己大動脈の感染のみならず,人工血管感染などが存在し,外科的治療を大変困難にします.治療の基本である感染巣の徹底的な郭清,再発予防のための人工血管のリファンピシン浸漬,人工血管周囲への大網充填などの工夫を行いその治療に果敢に挑戦しています.また時に食道や肺などの周囲臓器に穿孔することがあり,心臓血管外科のみならず他科との連携が重要になります.当科における大動脈関連感染疾患70例の患者背景,感染部位,ステントグラフトを含む外科治療成績を報告してきました.
Yamanaka K, Omura A, Nomura Y, Miyahara S, Shirasaka T, Sakamoto T, Inoue T, Matsumori M, Minami H, Okada K, Okita Y
Surgical strategy for aorta - related infection
Eur J Cardiothoracic Surg in press
本論文では死亡率は17.1%といまだ高値ですが,上記の工夫を加えることで解剖学再建が非解剖学再建やステントグラフト治療よりも優れていることを示しました(図).
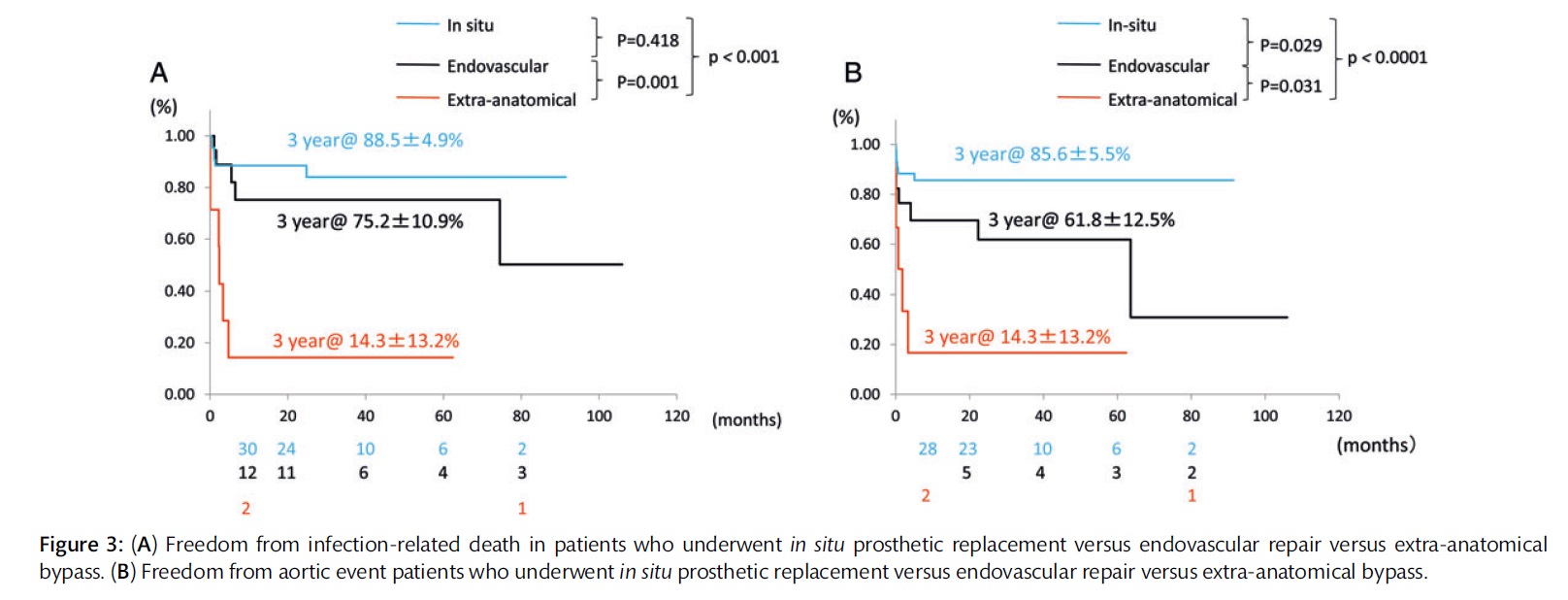
特に感染性遠位弓部大動脈瘤はpenetrating atherosclerotic ulcer (PAU)に起因することが多く(図),大網充填,人工血管のリファンピシン浸漬等をおこなうことで成績が極めて安定していることも報告しております.
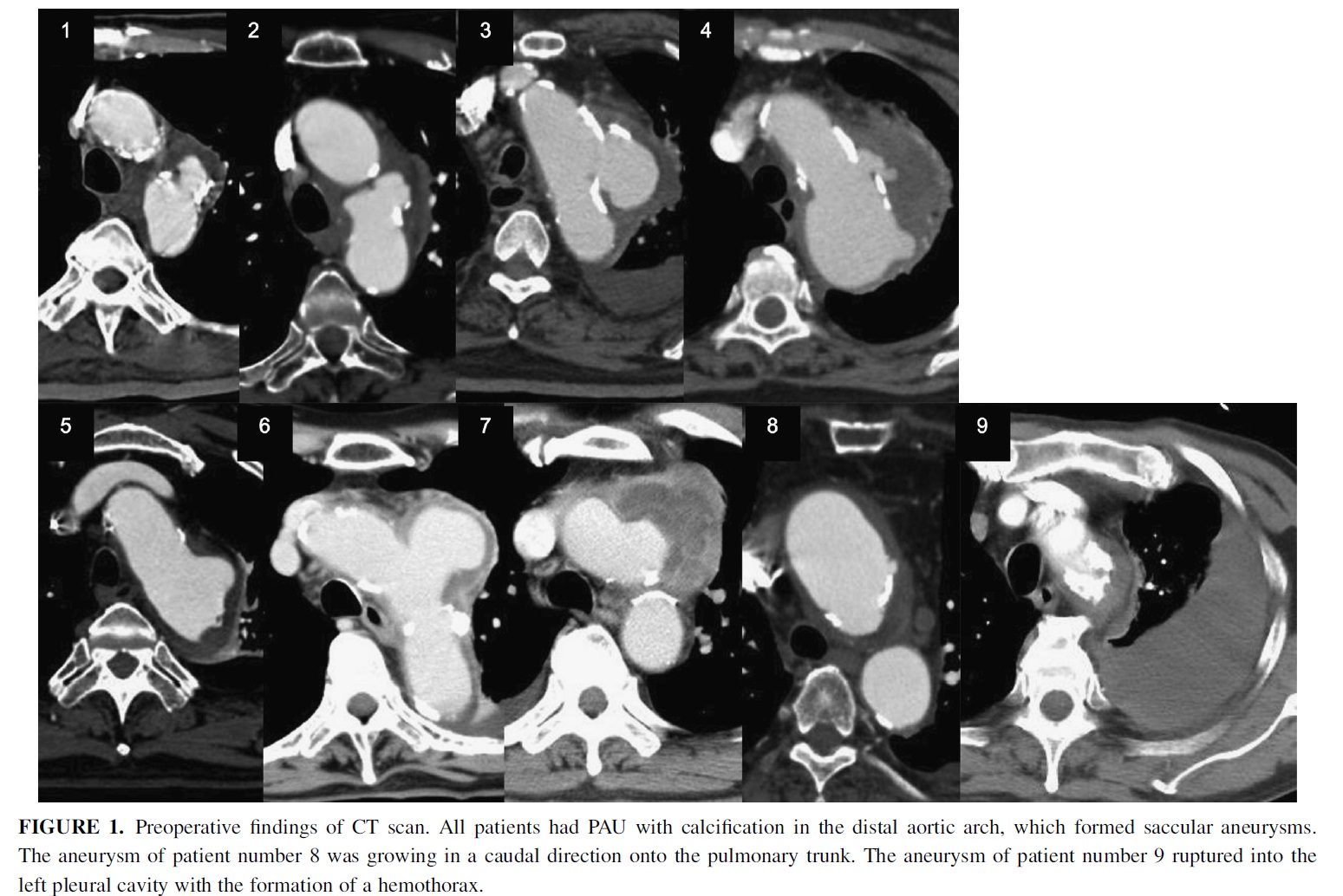
Okada K, Yamanaka K, Sakamoto T, Inoue T, Matsumori M, Kawakami F, Okita Y In situ total aortic arch replacement for infected distal aortic arch aneurysms with penetrating atherosclerotic ulcer J Thorac Cardiovasc Surg in press
中でも大動脈食道瘻は治療が最も困難な大動脈感染性疾患で当科では2008年以降開胸手術に先立ちステントグラフト内挿術を先行することで良好な成績を納めています。本疾患は出血のコントロールと大動脈ならびに食道に対する処置が必要で集学的治療を必要とします。まず緊急でステントグラフトを一時的に留置し出血のコントロールを行います。その後全身状態が安定した後に(約1週間以内)ステントグラフト、大動脈、食道を同時に摘除し、そしてリファンピリン浸漬人工血管を用いて解剖学的血行再建と大網充填を行います。さらに2〜3ヶ月後に食道の再建術を行います。当院食道胃腸外科と綿密に連携をとることで良好な結果を納めています。大北教授が現在に至る外科治療の時代背景も含め16例の報告をしております.

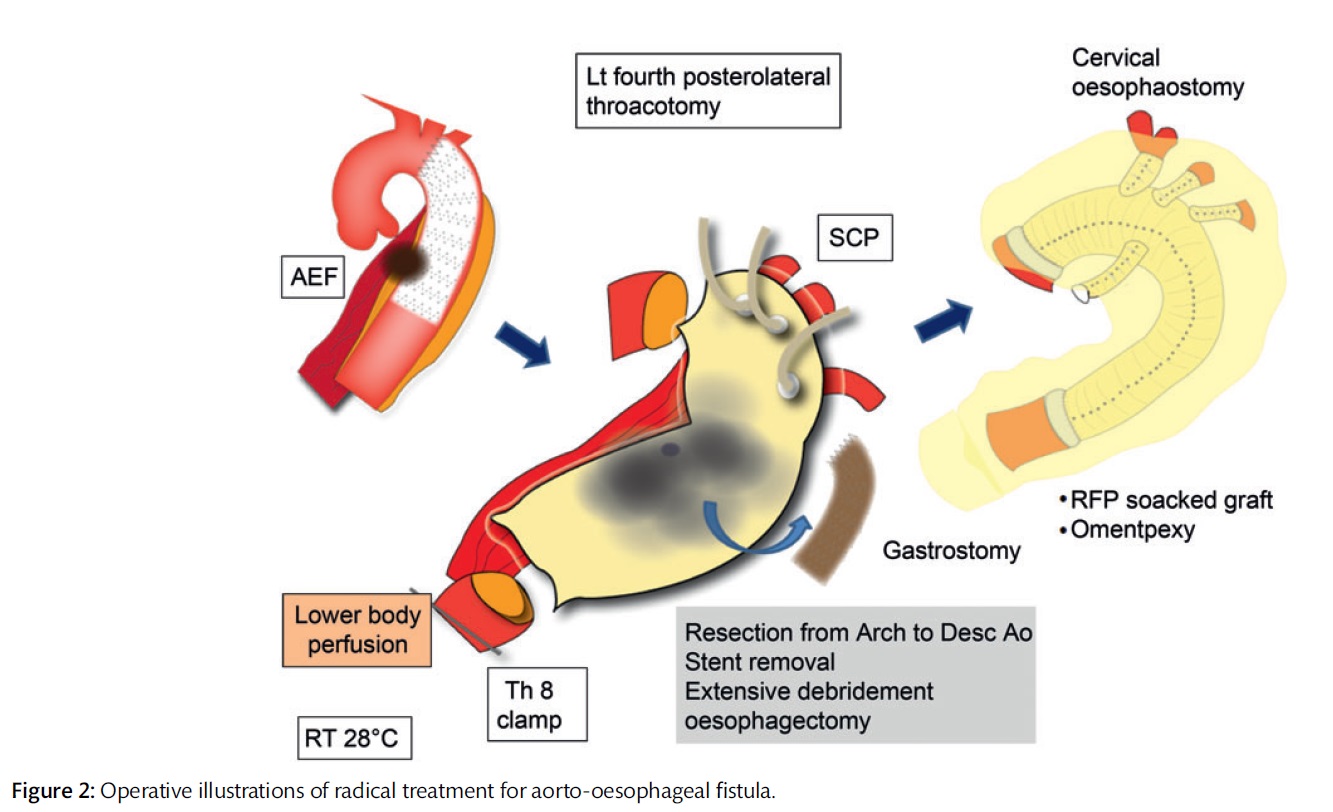
Okita Y, Yamanaka K, Okada K, Matsumori M, Inoue T, Fukase K, Sakamoto T, Miyahara S, Shirasaka T, Izawa N, Ohara T, Nomura Y, Nakai H, Gotake Y, Kano H.
Strategies for the treatment of aorto-oesophageal fistula.
Eur J Cardiothorac Surg in press
Munakata H, Yamanaka K, Nomura Y, Sakamoto T, Miyahara S, Oka T, Okada K, Okita Y
Surgical Technique: Successful surgical treatment of aortoesophageal fistula after emergent thoracic endovascular aortic repair: Aggressive debridement including esophageal resection and extended aortic replacement
J Thorac Cardiovasc Surg 2013 Jul;146(1):235-7
Tanaka A, Sakamoto T, Matsumori M, Imanishi T, Nakamura T, Okada K, Okita Y
A cure with successful staged treatment of aortoesophageal fistula
Gen Thorac Cardiovasc Surg in press
感染性心内膜炎
感染性心内膜炎は敗血症、弁破壊により心不全をきたす重篤な疾患である。この疾患の外科治療の重要な問題点は感染が弁輪部に波及し弁輪部膿瘍を形成すること、もう一点は疣贅が遊離したseptic emboliにより脳梗塞の発症すること、その出血性脳梗塞発症の危険性が高い早期に手術を施行しなくてならないことである。弁輪部膿瘍は手術を難しくし遠隔期感染再発の危険性を有する。以下、弁輪部膿瘍に対する当科の解析をおこなった。
Okada K, Tanaka H, Takahashi H, Morimoto N, Munakata H, Asano M, Matsumori M, Kawanishi Y, Nakagiri K, Okita Y. Aortic root replacement for destructive aortic valve endocarditis with left ventricular-aortic discontinuity. Ann Thorac Surg 2008 March;85(3):940-5.
大動脈基部膿瘍形成により引き起こされる左室と大動脈が離解するLeft Ventricular-Aortic Discontinuityは極めて治療が困難な病態であり成績は不良である。手術治療の工夫が重要で、膿瘍腔の徹底的な廓清、破壊された弁輪の再建、大動脈基部再建のための導管の選択は良好な近接、遠隔期の成績を決定する。導管にはステントレス生体弁もしくは自己肺動脈導管(Ross手術)を施行した。病院死亡、遠隔死亡ともに認めず良好な成績をおさめた。
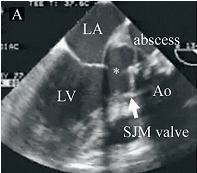
図は胸壁心エコー図検査所見。機械弁による大動脈置換術後の人工弁感染とそれに伴う弁輪部膿瘍、Left Ventricular-Aortic Discontinuity(*)を示す。左室と大動脈基部が離解している。
既に脳出血をきたした場合には抗凝固が必須の人工心肺を使用した手術は出血の悪化、脳障害の進行が予想され極めて危険である。そのため当施設においてnafamostat mesilateを併用しヘパリン減量することで良好な結果を得ている。
Ota T, Okada K, Kano H, Okita Y. Cardiopulmonary bypass using nafamostat mesilate for patients with infective endocarditis and recent intracranial hemorrhage. Interact Cardiovasc Thorac Surg 2007 June;6(3):270-3.
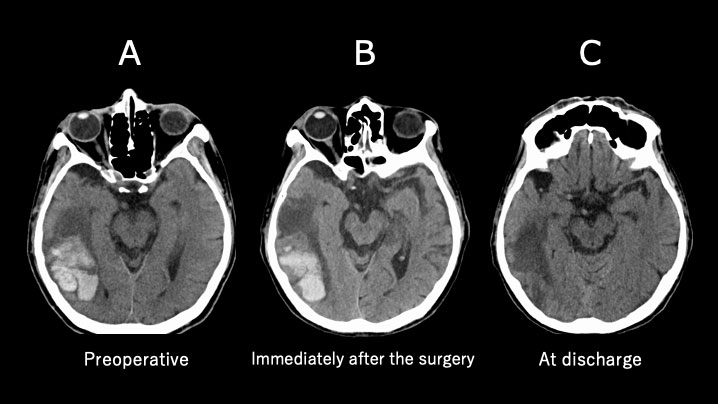
75歳女性 術前に多発性脳出血を認めた。
nafamostat mesilate併用しヘパリン減少することで脳合併症の悪化は認めなかった。
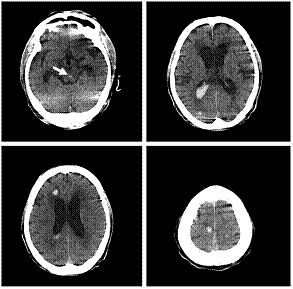
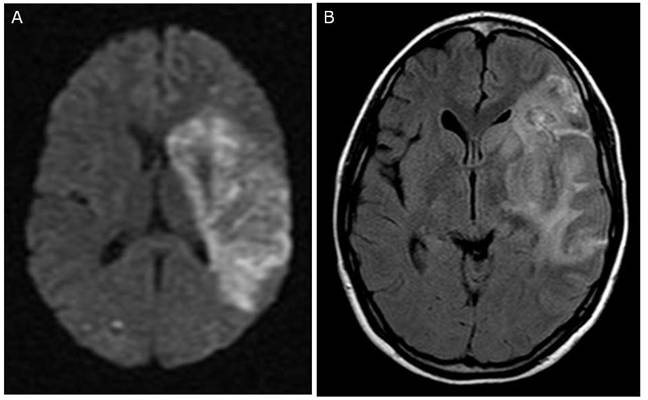
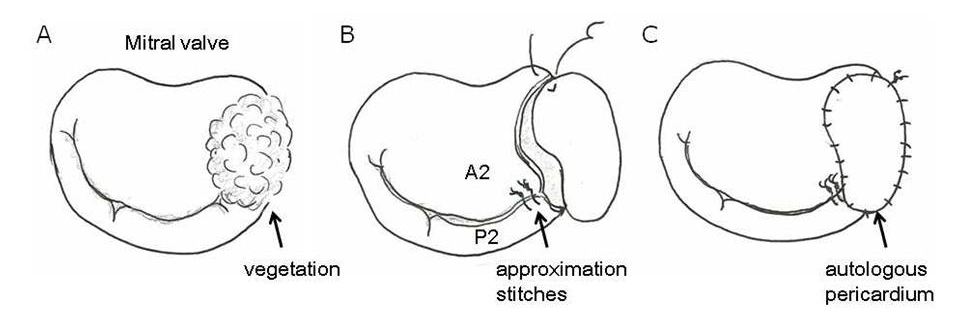
我々の施設ではOta T等の報告以降も、動物実験から得られたデータをもとに種々の工夫を重ね、脳出血、脳梗塞を合併した感染性心内膜炎症例にNafamostat mesilate併用・ヘパリン減量法を応用し続けています。術前疣贅による中大脳動脈閉塞による広範囲脳梗塞(下図左)をきたした19歳の女性に対し、同法を適応し僧帽弁形成術(下図)を脳出血など脳障害の悪化をきたすことなく安全に施行しえました。術前意識障害を認めた患者さんも術後3年が経過しますが日常生活に復帰されています。 Okada K, Shirasaka T, Kano H, Okita Y
Mitral valve repair in active infective endocarditis with cerebral infarction.
Asian Cardiovascular and Thoracic Annals 2013 Apr;21(2):215-7.