研究内容

【1】研究室紹介
私達の研究室は、2000年に群馬大学生体調節研究所に的崎が教授として着任したことによりスタートし(バイオシグナル分野)、2010年に的崎が現所属(神戸大学医学研究科)に異動したことに伴い、シグナル統合学分野として神戸の地で研究活動を開始、さらに2022年よりは、同研究科内に新たに設置された生体シグナル制御学部門に移り研究活動を行なっております。
この間、私達の研究室では一貫して生命科学の多くの領域で基本となる新たな細胞内あるいは細胞間のシグナル伝達機構を明らかにするという目標のもと、新規のシグナル伝達分子を同定し、これにつき分子生物学、細胞生物学、細胞工学など幅広い研究手法を用いその機能解析を行って参りました。その結果、現在は、私達の研究室で見出した細胞間シグナル伝達システムであるCD47-SIRPα系に関して、その生理機能と意義ならびに様々な難病(がん、神経疾患、免疫異常など)との関連する研究に注力しております。また、CD47-SIRPα系の抗体などを、上記の難病の治療法へ応用する創薬研究を製薬企業と共同して進めております。
私達の研究室のもう1つの目標は、上記の研究活動を通じて、国内外で活躍できる次世代の生命・医学研究者を育成することです。すでに、当研究室に過去に参加したメンバーが、国内外で生命・医学系の研究室PIとなり、独自の新しい研究を進めております。また、当研究室を卒業後、医師として出身の臨床医学講座や病院などに進んだ際、あるいは製薬やバイオ関連など様々な企業等へと進んだ場合でも、キャリアーパスや業務に当研究室での経験が非常に役立っているようです。さらに、当研究室では、これまでアジア・欧州・アフリカを中心とした海外からの留学生(大学院生)やポスドクも多数受け入れており、外国人研究者にとっても優れたキャリアーパスを付与できる研究室であると自負しております。
今後も引き続き、学域、国籍をも超えて生命・医学研究を志向する多くの方々の当研究室への参加を強く希望致しております。
2024年7月
的崎 尚
神戸大学大学院医学研究科 生化学・分子生物学講座 生体シグナル制御学部門
特命教授
【2】研究内容
1. 細胞間シグナル伝達システムCD47-SIRPα系の生理機能とその医学応用
多細胞生物の個体を形成する様々な種類の細胞は、互いにシグナルを受け渡しすることにより協調的に作用しあい、その結果多様な生体機能が発現します。細胞間のシグナル伝達には2つの基本形があり、可溶性リガンドが受容体へ結合してシグナルを伝達する場合と、シグナルを伝える側の細胞上に固定された膜結合型のリガンド分子が、標的細胞上の受容体分子に直接会合することによりシグナルを伝える機構が知られています(図1)。
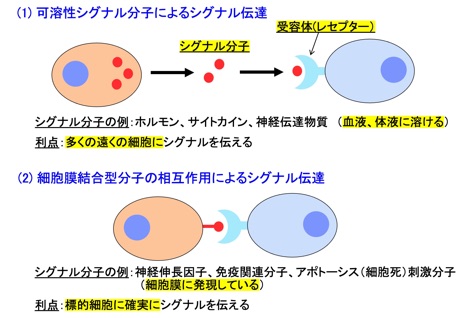
図1 細胞間シグナル伝達の基本型
私達は、後者の細胞間シグナル伝達システムに相当すると考えられるCD47-SIRPα系を見出し(Motegi, EMBO J., 2003;Matozaki et al., TCB, 2009)、その生理機能と病態への関与につきこれまで研究を継続しています。CD47-SIRPα系は、1回膜貫通型のレセプター型分子であるSIRPα(私共が発見当時はSHPS-1と命名)と、その細胞外ドメインの生理的なリガンドである5回膜貫通型分子であるCD47により構成されます(図2)。SIRPαとCD47の相互作用には、SIRPαの細胞外領域N末端Ig-Vドメインが重要です。また、SIRPαの機能には、SIRPαの細胞内ドメインのチロシンリン酸化が重要であり、その結果、チロシンホスファターゼであるShp1あるいはShp2が結合しSIRPαの下流分シグナルとして機能することが考えられます。実は、SIRPα/SHPS-1は、的崎が、このShp1/2チロシンホスファターゼの機能と作用機序につき研究していた過程で、Shp1/2の結合基質分子として発見しました(Fujioka, MCB, 1996)。
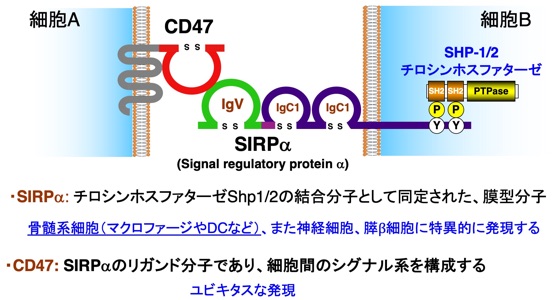
図2 CD47-SIRPα系
そして、このシグナル系の特徴として、CD47はほとんどすべての正常細胞や異常細胞であるがん細胞にも発現を認めますが、SIRPαは、血液・免疫系ではマクロファージ(MΦ)、樹状細胞(DC)、ミクログリア(神経系)など骨髄系細胞に、他の組織では神経細胞と膵臓のβ細胞に限局して強く発現しており、これらの組織、細胞での特異的な機能が想定されました。
とりわけ最近では、CD47-SIRPα系の血液・免疫系や神経系での生理機能や病態への関与が明らかになり、またこの系を利用したがんの治療などへの応用が進んでいるので、そのことにつき以下に述べたいと思います。
2. CD47-SIRPα系によるマクロファージの細胞貪食機能制御と正常血液細胞の生存・維持機序における重要性
血液細胞である赤血球、白血球、血小板は、比較的短命な細胞であり、ヒトの場合、各々120日、数時間~数日、約10日と異なる寿命を持つ。これらの血液細胞はすべて造血幹細胞から分化成熟し機能した後、細胞膜の変化などなんらかの「老化シグナル」を発することにより、それを感知したマクロファージ(MΦ)や樹状細胞(DC)などいわゆる自然免疫細胞により異化・処理され、組織や個体の恒常性が維持されると考えられているが、この老化シグナル自体や自然免疫細胞による感知の機序については、ほとんど明らかでありませんでした。私達は、CD47-SIRPα系が、この自然免疫細胞による正常血液細胞の生存・維持とそれが機能を終え不要となった際の排除の制御に重要なシグナル系であることを明らかにしています。
すなわち、CD47遺伝子欠損(KO)マウスの赤血球を野生型マウスに輸血するとこのCD47欠損赤血球はレシピエントマウスの末梢血中より急速に消失し脾臓の赤脾髄MΦに取り込まれることが示されていました(Oldenborg et al., Science, 2000)(図3A)。さらに、私たちは、CD47-SIRPα結合を阻害する抗体やSIRPα KOマウスなどを用いた解析から、血球細胞に発現するCD47が、MΦに発現するSIRPαに結合することにより、MΦによるCD47発現細胞の抗体依存性貪食(ADCP)を抑制することを、この抑制作用にはSIRPαの細胞内領域に結合するShp-1チロシンホスファターゼの関与が重要であることを明らかにしました(Ishikwa-Sekigami et al.blood, 2006; Matozaki et al., TCB, 2009)(図3B)。老化した赤血球ではCD47発現が減少することも報告され(Wang et al., Aging Cell, 2020)、以上から、健康で機能的な赤血球は、CD47-SIRPα系を介してMΦによる貪食を抑制することでその生存が維持される。他方、例えば老化した赤血球ではCD47の発現減少によりCD47-SIRPα系の抑制作用が解除され、結果としてMΦによる貪食・異化が促進され、これが赤血球の寿命制御の機序として重要であることが示唆されました(図3B)。
私たちは、さらに最近、正常T細胞の生存・維持の調節にはDCがCD47-SIRPα系を介して重要な役割を果たしていることを明らかにしており(Komori et al, PNAS, 2023)、その詳細な分子機序につき現在さらに研究を進めています(研究内容の5.を参照ください)。
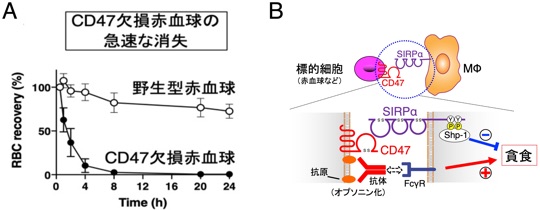
図3 CD47-SIRPα系によるマクロファージの貪食制御
3. CD47-SIRPα系による自然免疫細胞の機能制御と新規がん治療法開発
従来、がんの治療薬開発では、がん細胞自体の特異的な死滅を狙った薬剤の開発が主流でした。しかし、近年、がん細胞が、それを取り巻く「がん微小環境」に存在する様々な免疫細胞を能動的に制御することにより、がん細胞の生存に有利な環境を作り出すことが明らかにされており(図4)、特に、がんを攻撃・死滅させようとするキラーT細胞の作用をPD-1/PD-L1系を介してがん細胞が抑制していることが示され、この機構に着目したPD-1/PD-L1系の阻害抗体がいわゆる免疫チェックポイント阻害剤として多様ながんの治療に有効であることが明らかにされつつあります。
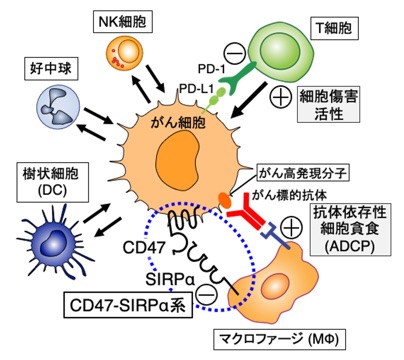
図4 がん微小環境におけるがん細胞と免疫細胞との双方向的制御
一方、がん細胞がマクロファージ(MΦ)や樹状細胞(DC)などの自然免疫細胞に対してはいかに振る舞い、がんの免疫監視と排除を回避するのかその分子機構は不明でした。そこで、MΦによるがん細胞の貪食・排除の制御においてもCD47-SIRPα系が重要であると考え検討を行った結果、CD47-SIRPα結合を阻害する抗SIRPα抗体が、MΦによるがん細胞の抗体依存性細胞貪食(ADCP)を高め、リツキシマブ(抗CD20抗体)など抗体医薬による腫瘍排除を増強することを明らかにしました(Yanagita, JCI Insight, 2017; Murata et al., Cancer Sci, 2018など)。この結果から、がん細胞はCD47を高度に発現しSIRPαに作用することで、MΦの貪食を負に制御し、貪食細胞によるがん細胞の排除を回避する機序が強く示唆されると共に(図5左)、CD47-SIRPα結合を阻害する抗SIRPα抗体が、リツキシマブなど抗体医薬の効果を増強する新規の作用機序を持つ抗腫瘍剤として利用できることを明らかにしました(図5右)(プレスリリース, https://www.kobe-u.ac.jp/ja/news/article/2017_01_13_02/)。以上の成果に基づき、製薬企業と共同で完全ヒト型抗SIRPα抗体を作製し、その臨床試験がすでに開始されています(https://clinicaltrials.gov/study/NCT05765851?term=DS-1103a&rank=1)。
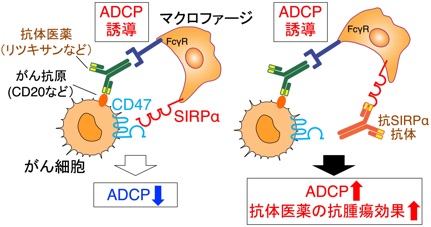
図5 CD47-SIRPα系によるマクロファージの貪食制御とそのがん治療への応用
また、抗体に匹敵する強力な結合能(阻害能)、高い安定性、低抗原性を持つと考えられるSIRPα結合性特殊環状ペプチド(D-アミノ酸を含む10-16程度のアミノ酸からなる大環状構造ペプチド)が、CD47-SIRPα結合をアロステリックに阻害して抗体に匹敵する抗腫瘍効果を示すことを明らかにし、次世代型のSIRPα阻害剤として臨床導入へ向けた研究開発も進めております(Hazama, Cell Chem Biol, 2020)(プレスリリース, https://www.kobe-u.ac.jp/ja/news/article/2020_07_08_01/)(図6)。
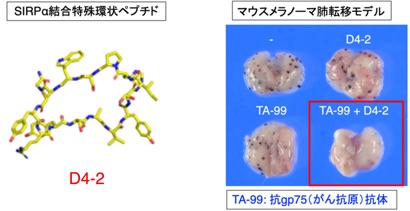
図6 抗腫瘍剤としてのSIRPα結合特殊環状ペプチドの利用
さらに、私達は、SIRPα非発現の膀胱がん細胞や乳がん細胞では、抗SIRPα抗体の単独投与がMΦの作用を介して腫瘍の細胞死を誘導し顕著な腫瘍抑制効果を示すことを見出しています(図7A)。さらに、この抗腫瘍効果には、抗SIRPα抗体が認識・結合する膜型分子SIRPβが関与することを明らかにしつつあります。SIRPβは、MΦに高度に発SIRPβは、その細胞外領域はSIRPαと相同性が高いが、その細胞内領域にはDAP-12/Sykチロシンキナーゼが会合し、MΦの活性化に関与する活性化膜分子であり抑制化膜分子のSIRPαといわゆるペア型レセプターを形成することを、私達は以前に見出していました(Matozaki et al., TCB, 2009)(図7B)。さらに、このSIRPβの特異抗体がMΦや好中球によるがん細胞の貪食や細胞傷害活性を刺激して抗腫瘍効果を示すことに明らかにしつつあり、現在、SIRPβを標的とした新たな抗腫瘍剤の開発を目指して研究を進めております(プレスリリース, https://www.kobe-u.ac.jp/ja/news/article/2021_12_21_01/)。
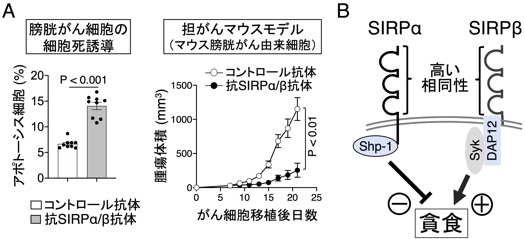
図7 膀胱がんに対するマクロファージを介した抗SIRPα/β抗体の抗腫瘍効果
抗ヒトSIRPα抗体をはじめ、免疫細胞を標的とするヒト抗体医薬の臨床開発において、前臨床段階でその薬効を確認できる系があれば極めて有用です。私達は、ヒト臍帯血由来造血幹細胞を移植した免疫細胞ヒト化マウス(MISTRGマウス)などを用い、抗ヒトSIRPα抗体をモデルとしてのその抗腫瘍効果を評価する系を確立し、患者由来のがん細胞を移植できる系の構築も可能にしています(図8)(Saito et al., Front. Immunol., 2023)。今後は、この免疫細胞ヒト化マウスを、私達が開発を予定しているCD47-SIRPα系やその関連分子の抗体の有効性の前臨床における検証に投入すると共に、既存の免疫チェックポイント阻害剤も含めた免疫細胞を標的とする抗腫瘍剤の薬効を治療前に確認できる個別医療を目指した評価系の確立に利用できるよう、さらに開発を進めています(プレスリリース, https://www.kobe-u.ac.jp/ja/news/article/20231213-21734/)。
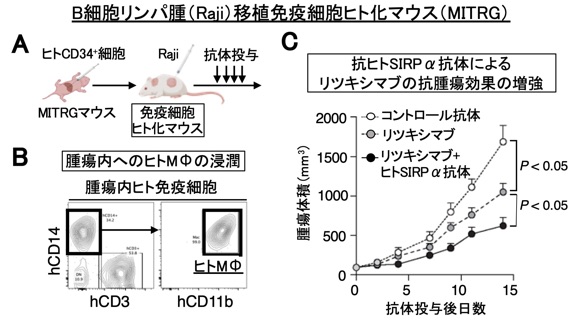
図8 免疫細胞ヒト化マウスにおける抗ヒトSIRPα抗体によるリツキシマブの抗腫瘍効果の増強
4. CD47-SIRPα系による樹状細胞機能の生存制御と獲得免疫系の活性化制御における重要性について
私達は、すでに、SIRPαが獲得免疫系の活性化に重要であるCD11c陽性の樹状細胞(cDC)、その中でもヘルパーT細胞の誘導に重要とされるCD4陽性cDC(DC2)に強く発現することを明らかにしております(Okajo et al., J. Immunol., 2007; Saito et al., Blood, 2010)。さらに、全身性SIRPαKOマウスやcDC特異的SIRPαKOマウスでは、DC2のみが著しく減少することから、DC2の生存制御においては、DC2上に発現するSIRPαとCD47のCisの相互作用が重要であると考えており(図9)、現在、その分子機序につきさらに検討を進めております。
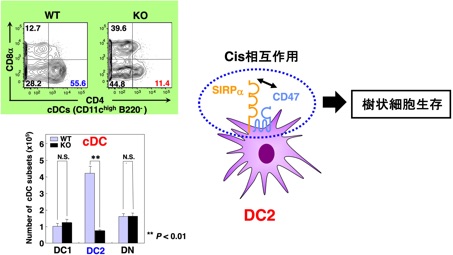
図9 樹状細胞の生存制御におけるCD47-SIRPα系の役割
さらに、私達は、自己免疫疾患のマウスモデルである実験的脳脊髄炎(多発性硬化症モデル)の発症が、全身性SIRPαKOマウスやcDC特異的SIRPαKOマウスで著しく抑制され、実際にこれらのマウスでは、抗原特異的なIL-17産生Tヘルパー(Th17)細胞誘導が障害されていることを見出しています(Tomizawa et al., J. Immuol., 2007; Nishimura et al., Eur. J. Immunol., 2020)(図10)。その原因としては、やはりこれらKOマウスにおけるDC2の減少によるTh17細胞の誘導自体の低下が最も考えられますが、炎症下におけるCD47-SIRPα系によるDC2の生存維持についてもさらに詳細な解析を進めております。また、私共は、がん治療と同様な抗SIRPα阻害抗体を用いた自己免疫性疾患の治療的応用も進めています。
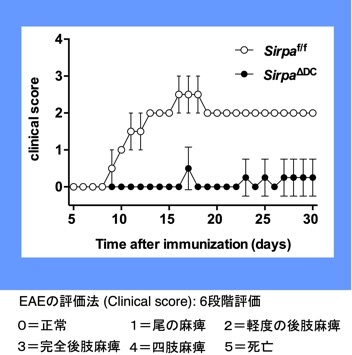
図10 樹状細胞特異的SIRPαKOマウスにおけるMOG誘導性EAEに対する抵抗性
5. CD47-SIRPα系を介したDCによる血球細胞とがん細胞の生存・維持と排除の分子基盤解明
前項2で述べたように、CD47 KOマウスより得られた赤血球のみならずリンパ球を野生型マウスに輸注すると、このCD47欠損リンパ球は速やかにレシピエントマウスから消失することが知られており、この過程には、DCの関与が示唆されていたが詳細な機序は明らかでありませんでした(Blazar et al., JEM, 2001)。最近、私達がT細胞特異的にCD47を欠損したマウス(Cd47ΔT)を作成したところ、2次リンパ組織や血中のT細胞が著減することを見出し(図11A)、この要因として、CD11c+CD4+DC (cDC2)の著しい活性化(図11B)とそれに起因するCD47欠損T細胞の細胞死(necroptosis)が誘導されることを見出しています。すなわち、正常T細胞上のCD47は、cDC2のSIRPαと相互作用することによりcDC2の活性化を抑制しT細胞の生存は維持されるが、他方、何らかの要因でCD47の発現が損なわれたT細胞では、CD47-SIRPα相互作用の喪失に起因したcDC2の過度な活性化によりT細胞の細胞死が誘導され排除される機序の存在が強く示唆されました (Komori et al, PNAS, 2023)。
以上の結果から、「2. CD47-SIRPα系によるマクロファージの細胞貪食機能制御と正常血液細胞の生存・維持機序における重要性」でも紹介したように、正常な血球細胞に発現するCD47は、MΦやDCに発現するSIRPαに結合することでこれら自然免疫細胞の活性化を抑制することで、血球細胞の生存とその機能を保つ、他方、老化や感染などなんらかの原因でCD47の発現を失った血球細胞は、活性化したMΦやDCにより適切に生体から排除される生体恒常性維持の1つの機構が見えてきました。
さらに、がん細胞においても同様な自然免疫細胞を介したCD47-SIRPα系による制御が想定され、その分子機序を詳しく解明することにより、新規のがん治療法の創出が期待されます。
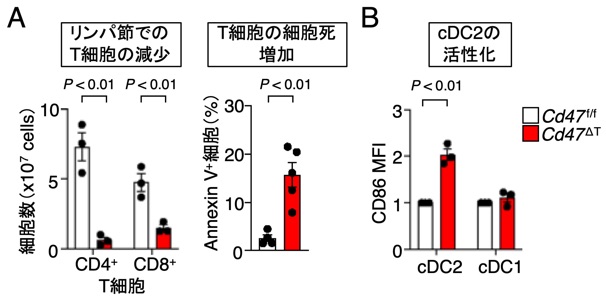
図11 T細胞特異的CD47欠損マウスにおけるT細胞の著減とcDC2の活性化
6. CD47-SIRPα系の神経系での生理機能や病態への関与、今後
SIRPαは、当初、神経細胞に高度に発現する分子としても同定されました(Ohnishi et al. J. Neurosci., 2005)。とくに、神経細胞のシナプスに局在して高度に発現することが示され、さらに、SIRPαKOマウスが、うつ行動のモデルである強制水泳テスト(Forced Swim Test, FST)において強いうつ傾向を示すことから(Ohnishi et al., J. Neurosci., 2010)、CD47-SIRPα系は、脳においてストレスを感知しうつ状態の制御に関与していることが示唆されています。しかしながら、神経細胞に発現するCD47-SIRPα系の生理的な役割は依然よくわかっていない状況です。
他方、最近、私達は、群馬大学の大西浩史先生との共同研究で、神経軸索の主要構成分子であるミエリンの産生細胞であるオリゴデンドロサイトの生存・維持に、SIRPαを高度に発現するミクログリア(MG)がCD47-SIRPα系を介して重要な役割を果たしていることを明らかにしつつあります(Sato-Hashimoto et al., eLife, 2019)(プレスリリース, https://www.gunma-u.ac.jp/information/53508)。脳内のMΦ様細胞であるMGは、貪食作用による脳内の損傷組織の除去や神経保護因子の産生により脳の恒常性維持に重要であることが示唆されています。今後さらに、CD47-SIRPα系によるMGの制御と、脱髄障害や加齢障害における病態的意義につき検討を進めるとともに、脱髄疾患や認知症の治療応用についても研究を進めていく予定です。
Copyright (C) 2024 神戸大学 生体シグナル制御学 All Rights Reserved.