超微量・超高感度検査機器に関する研究に関する報告書
2023年度 小型自動車等機械振興補助事業
補助事業番号: 2023M-367
この事業は、オートレースの補助を受けて実施した事業です。
Main Theme
本研究では、生体から採取された血液などの検体中に含まれる核酸やタンパク質を測定する体外診断において、検体を測定機関へ運ぶのではなく、検査システム自体の検査を必要とする場所へ持っていくという、だれでも、どこでも、いつでも検査≒「その場検査」の実現を目指し、独自の流体デバイス技術=mTAS(ミリタス)技術を開発する。
1.実施経過
① 超微量・超高感度検査機器に関する研究
検査項目決定・有識者へのヒアリング
2023年6月 神戸大学医学部附属病院小児科医師を中心にヒアリングを実施
研究開発推進と各研究へのフィードバック
2023年4月21日 キックオフミーティング(京都大学)
2023年5月23日 定期ミーティング(神戸大学)
2023年6月30日 共同研究契約締結(神戸大学・京都大学・iXflow社)
2023年8月04日 定期ミーティング(神戸大学)
2023年11月10日 定期ミーティング(神戸大学)
2023年12月01日 定期ミーティング(神戸大学)
2023年12月25日 実験検討&議論ミーティング(神戸大学)
2024年1月22-23日 実験検討&議論ミーティング(神戸大学)
2024年2月19日 定期ミーティング(神戸大学)
2024年3月12日 実験検討&議論ミーティング(神戸大学)
2024年3月17-19日 実験検討&定期ミーティング(神戸大学)
2024年3月28-29日 実験検討&議論ミーティング(神戸大学)
高感度多項目ELISAチップの構想・作成
2023年6月~7月 レザープラズモン励起蛍光現象を利用する高感度検出系構想
2023年6月~9月 ナノワイヤーを利用する高感度抗原抗体反応系での検討
検出光学系の検証/サンドイッチアッセイ開発
2023年6月~7月 ボードカメラと単純化光学系での化学発光検出系の構想
2023年8月~9月 単純化光学系の組立と実測による評価と課題抽出
2023年10月 制御装置への検出カメラ部の組み込み検討
2024年2月 手技による多項目検査ツール:OpenELISA用検出器作成
mTAS検査カートリッジの開発
2023年6月~7月 ELISA反応チャンバーの設計と試作
2023年7月~9月 ELISAチャンバーでの気泡抜き機構とチャンバー形状の最適化検討
2023年9月 ELISAアッセイのための液流し条件の検討
2023年10月~11月 mTAS-ELISAサンドイッチアッセイの液流しプロトコールの検討
2023年12月 手技による多項目タンパク検査系を構想し,カートリッジ作成
2023年12月 CEA,PSA,IL-6の多項目タンパク検査アレイの作成
2024年1月~2月 OpenELISAでの多項目タンパク検査の実験検討
2024年3月 mTAS-ELISAカートリッジでの多項目タンパク検査測定
高感度検査向け液流し制御装置開発
2023年8月~9月 液流し制御装置の改造設計と部品発注および組立開始
2023年10月~2024年3月 液流し制御/検出装置の製作(iXlow+安西氏)
2.実施内容
① 超微量・超高感度検査機器に関する研究
検査項目決定・有識者へのヒアリング
- 神戸大学医学部を中心に,検体診療検査において診断・治療へ有用となる多項目検査情報について,検討方針を考えるためのヒアリングを行った
- 感染症に対しての情報としては,手軽なPCR検査による原因菌同定の遺伝子検査の有効性が確認できた
- 様々な病態での検査としては,CRPやプレカレストンや各種サイトカイン等の体内での炎症についてを検査・分析にて情報を売ることができる炎症マーカー検査
- 検査装置の検出感度と検出対象物の検体中の存在量を加味しながら,実際の検査系に搭載する検査項目について検討をすすめ,更に高感度が必要な場合には,その点の技術開発も視野に検討を進める.
研究開発推進と各研究のフィードバック
- 定期的な共同研究者によるミーティングにより研究開発の進め方,検討計画,実験検討結果の共有
- WEB会議や現地(神戸大学)での会議を実施し,検討の方向性議論,検討内容と進捗についての議論を行い,次の検討方向性について確認した.
高感度多項目ELISAチップの構想・作成
《レザープラズモンによる高感度抗原抗体反応系の検討@京都大学》
- スキルレス・自動測定装置には,化学発光検出系でのカートリッジ開発および制御/測定装置の開発を進めるが,更に高感度測定が必要である.また,高感度測定の実現により,さらに多くの情報を得ることが期待できることから,レーザープラズモン励起蛍光検出の件を先端的な研究開発として継続して進めている.具体的には,カーボンナノチューブを活用しての抗原抗体反応を使用するタンパク質検出/測定検出系の研究開発である.
検出光学系の検証/サンドイッチアッセイ開発
-
光重合性高分子膜を活用した多項目ELISAアッセイ用基板の作成検討を進めている.これまで,抗源を固定化して,検体中の抗体を結合アッセイする系の構築は行ってきた.検体中のタンパク質を測定するには,補足抗体を基板に固定化する必要がある.今回,腫瘍マーカーであるαフェトプロテインをターゲットとし,市販されている補足抗体をこれまでの固定化法によって基板にスポットすることで,検体中のタンパク質測定を可能にするアッセイ系の構築を確認した.
検出光学系の検証/サンドイッチアッセイ開発
-
光重合性高分子膜を活用した多項目ELISAアッセイ用基板の作成検討を進めている.これまで,抗源を固定化して,検体中の抗体を結合アッセイする系の構築は行ってきた.検体中のタンパク質を測定するには,補足抗体を基板に固定化する必要がある.今回,腫瘍マーカーであるαフェトプロテインをターゲットとし,市販されている補足抗体をこれまでの固定化法によって基板にスポットすることで,検体中のタンパク質測定を可能にするアッセイ系の構築を確認した.

-
この新規考案の低価格光学系を制御/検出装置に組み込みための治具設計および組み込みを実施した.
mTAS検査カートリッジの開発
《ELISA反応チャンバーの構造検討》
-
ELISAアッセイ系の検体投入,未反応物除去洗浄,認識抗体投入,未反応抗体の除去洗浄,標識抗体の投入,未反応標識抗体の除染洗浄,シグナル発生系試薬の導入と多段階となるアッセイ工程を実現する自動液流しのmTAS流体デバイスは,すでに開発品として有している.このmTAS-COREデバイスの先端に,上記のアッセイ系を実現するために,ELISAアッセイチャンバー流路を設計し,切削加工と複数部品の溶着により作成した.


《mTAS-カートリッジへのELISA反応チャンバーとの融合》
-
開発したELISA反応チャンバーを,液流し用mTAS-COREカートリッジへ結合させ,mTAS-ELISAカートリッジを作成した.

《多項目タンパク検査用のELISAアレイチップの作成とチャンバーへの組み込み》
-
多項目検査アッセイのために,複数の検査対象用補足抗体をポリカーボネート樹脂製の樹脂板材にスポットし,これを光重合反応により固定化をおこない,ELISAアレイを作製した.これをmTAS-カートリッジの反応チャンバー内へと搭載し,化学発光が多点で測定できることを確認した.


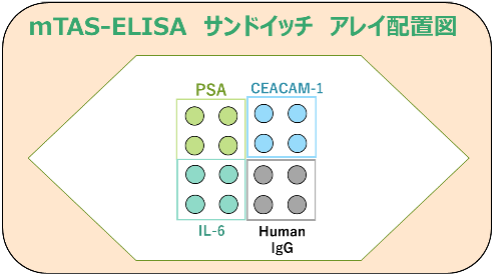
《mTAS-ELISAサンドイッチアッセイとELISAアレイチップスポットレイアウト》
-
多項目検査の項目については,腫瘍マーカーとして知られるCEAとPSAを選択し多項目検査腫瘍マーカー検査の有用性がある検査系を想定した.また,様々な疾患での検査に有用と考えれる炎症系のマーカーであるIL-6をサンドイッチアッセイの対象として選び,3種類のタンパク質検査が同時に行えるELISAアレイを作製し,mTAS-ELISAカートリッジへ搭載して,検体物質をスパイクした検体試料をつかって同時多項目測定できることを確認した.また,緩衝液や洗浄液の組成を様々検討し高感度化を検討し,良好な組み合わせを見いだした.
高感度検査向け液流し制御装置開発
《液流し制御装置制御装置の構想設計》
-
以前に開発した遺伝子検査向けの核酸精製・核酸検出装置向けの自動液流しを実現する装置システムの設計情報をもとに,本検討目的に適合した改良設計を行った
《液流し制御装置の製作を開始》(iXflow社+安西氏)
-
改良設計に従って,実際の部品を作成/購入して,組み立て製作を開始した.現時点では,Mainユニット・上部およびMiddleユニットが50%程度出来上がっている,
《自動液流し制御及び検出装置製作》(iXflow社+安西氏)
ナノワイヤー上タンパク質検出可能性の検討
-
定量検出システムを構築するためのモデル系として、本研究ではまず、市販の抗体を入手することが比較的容易な、TNF-aをターゲット検出抗原として用いることにした。まず、本研究で用いる抗体、抗原の組み合わせで、実際にナノワイヤー上での蛍光検出が可能かどうか調べるため、あらかじめ、ガラス基板上に固定化したナノワイヤーに対し、抗体および抗原を表面上で反応させた。具体的には、下記に示す手順で、まず、Biotint担持TNF-a一次抗体をナノワイヤー表面に修飾後、TNF-aを反応、さらにAlexa-647担持TNF-a一次抗体を反応させた後、励起光647nmにおけるナノワイヤー上の蛍光を確認した。その結果、Alexa-647担持TNF-a一次抗体を反応させた後のみ、ナノワイヤー上での蛍光を確認した。この結果から、今回用いた一次抗体の組み合わせで、ナノワイヤー上でのTNF-a検出が可能であると考えられる。
濃度の異なるタンパク質のナノワイヤー上検出可能性の検討
-
異なる濃度のタンパク質検出の可能性について検討するため、異なる濃度の蛍光タンパク質mCherry付きTNF-aを、抗体修飾ナノワイヤーと反応させ、そこで検出される蛍光強度変化を確認したところ、図2に示すようにタンパク質濃度の違いに応じた蛍光強度変化を確認することができた。今回使用したTNF-a抗体の結合解離定数は0.087
mMであることから、結合解離定数に近い濃度までのナノワイヤー上での標的タンパク質検出が可能であることを確認した。
ナノワイヤーを用いたタンパク質検出に関する将来展望
- 本研究を遂行するうえで、ナノワイヤー上への表面修飾を繰り返すプロセスにおいて、銀ナノワイヤーが固定しているタングステンワイヤーから取れる頻度が上がってしまう課題が生じた。今後、ナノワイヤープローブを用いて精度の高いタンパク質検出を行うためには、この課題を克服する必要がある。一つの方法として、最近報告されているQ-body抗体(H.
Ueda et al., Chem. Sci., 2022, 13,
9739)を用いることで、ナノワイヤー表面上へワンステップで直接抗体を修飾できる可能性があることから、今後はQ-bodyを含めた新規抗体を用いた表面修飾条件検討とタンパク質検出についても検討する。