ホーム これまでの研究内容 研究業績 お問い合わせ
これまでの研究内容
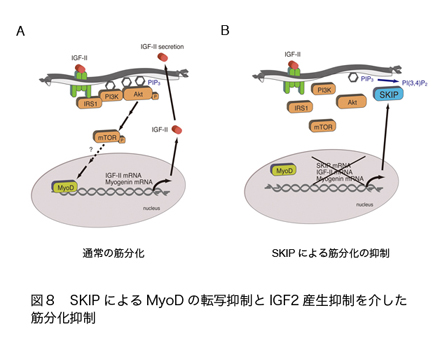
ホスファチジルイノシトール3リン酸(PIP3)は、細胞増殖シグナルを促進したり、アクチン細胞骨格系を再構築したりするセカンドメッセンジャーとして機能するホスホイノシチドである(図1)。また、AktやBtkなどのPHドメインと結合して、その活性を制御するバイオモジュレーターとしても機能する。PIP3は増殖因子刺激やインスリン刺激依存的にPI3キナーゼによって産生される脂質で、細胞増殖の促進・アポトーシスの抑制・lamellipodia形成促進による細胞運動能の促進・インスリン刺激依存的な細胞外からのグルコース取込みの促進など、基本的な生命現象に数多く関わっている。
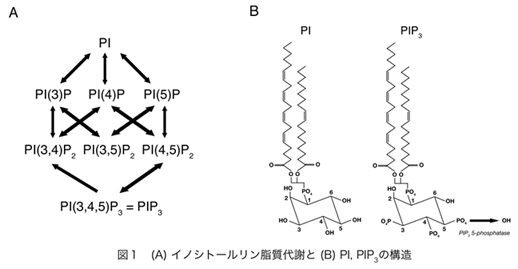
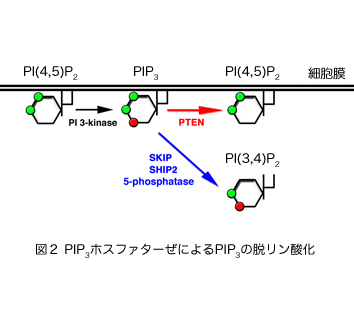
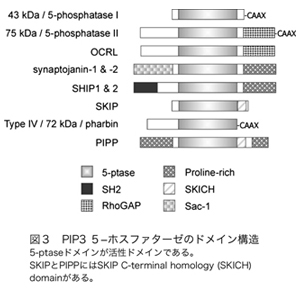
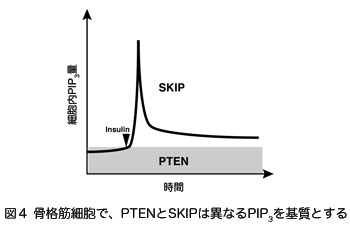
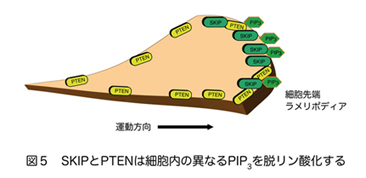
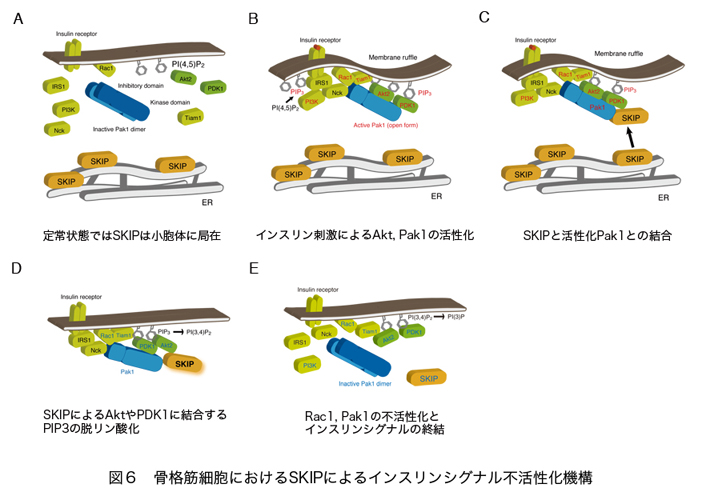
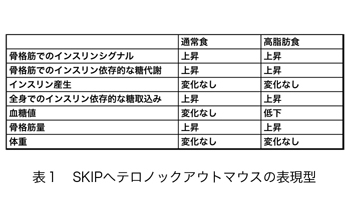
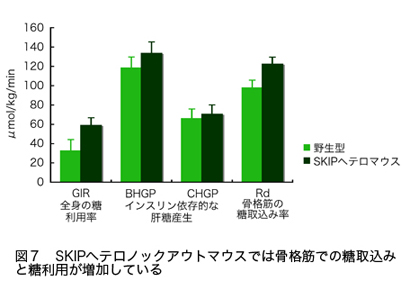
ホスホイノシチドホスファターゼはイノシトールリン脂質の脱リン酸化酵素の総称であり、約50種類以上ある分子の多くが、疾患の原因遺伝子として同定される重要な酵素である。そのうちPIP3ホスファターゼはPIP3を脱リン酸化しPIP2を産生する酵素である(図2)。PIP3ホスファターゼには10種類の分子が存在し、3位を脱リン酸化しPI(4,5)P2を産生するPTENと、5位を脱リン酸化してPI(3,4)P2を産生する5-ホスファターゼに分類される(図3)。PTENは代表的ながん抑制遺伝子であり、多くのがん患者において変異や欠失が認められる。それ以外にもPTENは血管新生や自己免疫疾患の原因となることが知られている。SHIP1は血球細胞の増殖やサイトカイン産生を負に制御する分子であり、炎症シグナルを負にコントロールしている。私は骨格筋に多く発現するPIP3ホスファターゼSKIP(Skeletal muscle and kidney enriched inositol polyphosphate phosphatase)が新しい糖尿病治療ターゲットとなることを証明することを目的として以下のような結果を示してきた。